题目内容
17.下列化学反应中,既是置换反应又是氧化还原反应的是( )| A. | 2Al+6HCl═2 AlCl3+3H2 | B. | 4Na+O2═2Na2O | ||
| C. | MgO+H2SO4═MgSO4+2H2O | D. | Ba(OH)2+H2SO4═BaSO4↓+2H2O |
分析 置换反应是一种单质和一种化合物反应生成另一种单质和另一种化合物,氧化还原反应是反应前后元素化合价发生改变的反应,以此解答该题.
解答 解:A.为置换反应,Al、H元素化合价发生变化,属于氧化还原反应,故A正确;
B.为化合反应,故B错误;
C.为复分解反应,元素化合价没有发生变化,不是氧化还原反应,故C错误;
D.为复分解反应,元素化合价没有发生变化,不是氧化还原反应,故D错误.
故选A.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应以及置换反应判断的考查,题目难度不大.

练习册系列答案
相关题目
7.某研究性学习小组欲探究影响锌和稀硫酸反应速率的外界条件,下表是其实验设计的有关数据:
(1)在此5组实验中,其速率最快的实验是5(填实验序号).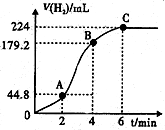
(2)对锌和稀硫酸反应,实验2和4表明,硫酸的浓度对反应速率有影响;实验1和3表明,是否形成原电池对反应速率有影响.
(3)进行实验2时,小组同学根据实验过程绘制的标准状况下的气体体积V与时间t的图象如图所示.
①在OA、AB、BC三段中反应速率最快的是AB,原因是反应放热,使温度升高,反应速率加快.
②2~4min内以硫酸的浓度变化表示的反应速率(假设溶液的体积不变)为0.06mol•L-1•min-1.
| 实验 序号 | 锌的质量/g | 锌的 状态 | c(H2SO4)/mol•L-1 | V(H2SO4)/mL | 反应前溶液的温度/℃ | 添加剂 |
| 1 | 0.65 | 粉状 | 0.5 | 50 | 20 | 无 |
| 2 | 0.65 | 粉末 | 0.5 | 50 | 20 | 无 |
| 3 | 0.65 | 粉状 | 0.5 | 50 | 20 | 2滴CuSO4溶液 |
| 4 | 0.65 | 粉末 | 0.8 | 50 | 20 | 无 |
| 5 | 0.65 | 粉末 | 0.8 | 50 | 35 | 2滴CuSO4溶液 |

(2)对锌和稀硫酸反应,实验2和4表明,硫酸的浓度对反应速率有影响;实验1和3表明,是否形成原电池对反应速率有影响.
(3)进行实验2时,小组同学根据实验过程绘制的标准状况下的气体体积V与时间t的图象如图所示.
①在OA、AB、BC三段中反应速率最快的是AB,原因是反应放热,使温度升高,反应速率加快.
②2~4min内以硫酸的浓度变化表示的反应速率(假设溶液的体积不变)为0.06mol•L-1•min-1.
5.对于有机物氯乙烷的认识,下列说法中错误的是( )
| A. | 用乙烷和氯气混合光照充分反应,可以制得比较纯净的氯乙烷 | |
| B. | 可以用质谱仪快速、微量、精确地测定它的相对分子质量 | |
| C. | 与其它卤代烃一样,不溶于水,能溶于有机溶剂 | |
| D. | 它在氢氧化钠水溶液中,可以水解发生取代反应,生成乙醇 |
12.能影响水的电离平衡,并使溶液中的c(H+)>c(OH-)的操作是( )
| A. | 向水中投入一小块金属钠 | B. | 将水加热煮沸 | ||
| C. | 向水中通入HCl气体 | D. | 向水中加食盐晶体 |
9.已知下列物质都可以将盐酸氧化成Cl2,并发生如下还原反应:
MnO4-→Mn2+; ClO3-→Cl2; MnO2→Mn2+; ClO-→Cl2;等物质的量的下列化合物与足量浓盐酸反应,得到Cl2的物质的量最少的是( )
MnO4-→Mn2+; ClO3-→Cl2; MnO2→Mn2+; ClO-→Cl2;等物质的量的下列化合物与足量浓盐酸反应,得到Cl2的物质的量最少的是( )
| A. | KClO3 | B. | KMnO4 | C. | MnO2 | D. | Ca(ClO)2 |
7.下列离子方程式书写正确的是( )
| A. | 漂白粉溶液中通入过量的CO2:Ca2++2ClO-+CO2+H2O═CaCO3↓+2HClO | |
| B. | 氯气与水的反应:Cl2+H2O═2H++Cl-+ClO- | |
| C. | NaHCO3溶液中加足量Ba(OH)2溶液:HCO3-+Ba2++OH-═BaCO3↓+H2O | |
| D. | 钠和冷水反应:Na+2H2O═Na++2OH?+H2↑ |
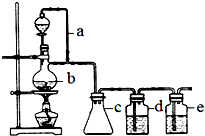 某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:
某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线: