题目内容
16.在CH3COOH?CH3COO-+H+的电离平衡中,要使平衡右移且c(H+)增大,应采取的措施是( )| A. | 加入烧碱 | B. | 加入盐酸 | C. | 升高温度 | D. | 加水 |
分析 A.加入NaOH,c(H+)减小;
B.加盐酸,氢离子浓度增大;
C.升高温度促进电离;
D.加水稀释氢离子浓度减小.
解答 解:A.加入烧碱溶液,反应生成CH3COO-,c(H+)减小,使电离平衡右移,故A不选;
B.加盐酸,氢离子浓度增大,但是电离平衡:CH3COOH?CH3COO-+H+左向移动,故B不选;
C.弱电解质的电离为吸热过程,加热促进电离,平衡右移,c(H+)增大,故C选;
D.加水,溶液体积增大,导致氢离子、醋酸浓度都减小,电离平衡:CH3COOH?CH3COO-+H+右向移动,故D不选.
故选C.
点评 本题考查弱电解质的电离,侧重于考查学生的分析能力和化学基本概念的理解和应用能力,为高考常见题型,难度中等,注意把握影响弱电解质的电离的影响因素.

练习册系列答案
相关题目
19.将固体NH4I置于密闭容器中,在一定温度下发生下列反应:①NH4I(s)?NH3(g)+HI(g) ②2HI(g)?H2(g)+I2(g).达到平衡时,c(H2)=1mol•L-1,c(HI)=4mol•L-1,则此温度下反应①的平衡常数为( )
| A. | 22 | B. | 24 | C. | 20 | D. | 25 |
7.某研究性学习小组欲探究影响锌和稀硫酸反应速率的外界条件,下表是其实验设计的有关数据:
(1)在此5组实验中,其速率最快的实验是5(填实验序号).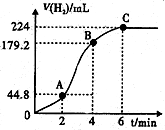
(2)对锌和稀硫酸反应,实验2和4表明,硫酸的浓度对反应速率有影响;实验1和3表明,是否形成原电池对反应速率有影响.
(3)进行实验2时,小组同学根据实验过程绘制的标准状况下的气体体积V与时间t的图象如图所示.
①在OA、AB、BC三段中反应速率最快的是AB,原因是反应放热,使温度升高,反应速率加快.
②2~4min内以硫酸的浓度变化表示的反应速率(假设溶液的体积不变)为0.06mol•L-1•min-1.
| 实验 序号 | 锌的质量/g | 锌的 状态 | c(H2SO4)/mol•L-1 | V(H2SO4)/mL | 反应前溶液的温度/℃ | 添加剂 |
| 1 | 0.65 | 粉状 | 0.5 | 50 | 20 | 无 |
| 2 | 0.65 | 粉末 | 0.5 | 50 | 20 | 无 |
| 3 | 0.65 | 粉状 | 0.5 | 50 | 20 | 2滴CuSO4溶液 |
| 4 | 0.65 | 粉末 | 0.8 | 50 | 20 | 无 |
| 5 | 0.65 | 粉末 | 0.8 | 50 | 35 | 2滴CuSO4溶液 |

(2)对锌和稀硫酸反应,实验2和4表明,硫酸的浓度对反应速率有影响;实验1和3表明,是否形成原电池对反应速率有影响.
(3)进行实验2时,小组同学根据实验过程绘制的标准状况下的气体体积V与时间t的图象如图所示.
①在OA、AB、BC三段中反应速率最快的是AB,原因是反应放热,使温度升高,反应速率加快.
②2~4min内以硫酸的浓度变化表示的反应速率(假设溶液的体积不变)为0.06mol•L-1•min-1.
4.下列电离方程式不正确的是( )
| A. | Ca(OH)═Ca2++2OH- | B. | KNO3═K++NO3- | C. | NH4Cl═4NH++Cl- | D. | H2SO4═2H++SO42- |
1.下列各组离子,能在溶液中大量共存的是( )
| A. | Fe2+.Na+.NO3-.H+ | B. | NH4+.Fe3+.SO42-.SCN- | ||
| C. | SO42-.Cl-.Cu2+.Mg2+ | D. | Ba2+.K+.SO32-.H+ |
5.对于有机物氯乙烷的认识,下列说法中错误的是( )
| A. | 用乙烷和氯气混合光照充分反应,可以制得比较纯净的氯乙烷 | |
| B. | 可以用质谱仪快速、微量、精确地测定它的相对分子质量 | |
| C. | 与其它卤代烃一样,不溶于水,能溶于有机溶剂 | |
| D. | 它在氢氧化钠水溶液中,可以水解发生取代反应,生成乙醇 |