题目内容
14.氮及其化合物在工农业生产、生活中有着重要作用.(1)图1是1molNO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式CO(g)+NO2(g)=CO2(g)+NO(g)△H=-234KJ/mol.
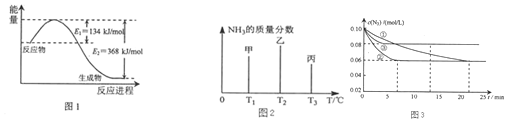
(2)在固定容积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1 用一定物质的量的N2和H2合成NH3,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其它条件相同的情况下,实验测得反应均进行到t min时NH3的质量分数如图2所示:
此时甲、乙、丙三个容器中一定达到化学平衡状态的是丙容器,都达到平衡状态时,NH3的质量分数最高的是甲容器(填甲、乙、丙).
图3是实验室在三个不同条件的密闭容器中,分别加入浓度均为c(N2)=0.10mol/L,c(H2)=0.26mol/L进行反应时,N2的浓度随时间的变化如图①、②、③曲线所示.
Ⅰ该反应实验②平衡时H2的转化率为46.15%.
Ⅱ据图3所示,②装置中有一个条件与①不同,请指出②相对①改变的条件加入催化剂.
Ⅲ计算实验③的平衡常数为2.5L2•mol-2.
(3)铜与一定浓度硝酸反应时方程式可表示为:Cu+HNO3一Cu(NO3)2+NO+NO2+H2O(方程式未配平).3.2g Cu被硝酸完全溶解后,如果得到的NO和NO2物质的量相同,则得到标准状况下NO体积为0.56L.
分析 (1)根据能量变化图,反应热=正反应的活化能-逆反应的活化能,结合热化学方程式的书写规则书写;
(2)依据氨气的质量分数变化可知,随温度升高,化学平衡应逆向进行,氨气的质量分数减小,丙氨气质量分数最小,所以丙一定是平衡状态,达到平衡状态,温度越高平衡逆向进行程度越大,氨气质量分数越小;
Ⅰ、实验②平衡时H2的转化率为α(H2)=$\frac{氢气浓度的变化量}{氢气浓度的起始量}×100%$.
Ⅱ、②到达平衡的时间比①短平衡时N2的浓度与①相同,化学平衡不移动;
Ⅲ、由平衡时氮气的浓度,通过三段式计算平衡时氮气氢气氨气的浓度,由平衡常数概念计算.
(3)铜与硝酸发生氧化还原反应,铜失去电子给硝酸中的氮元素,氧化还原反应得失电子总数相等,即铜失去的电子数=氮得到的电子数,可得答案.
解答 解:(1)该反应的焓变△H=E1-E2=134KJ/mol-368KJ/mol=-234KJ/mol,所以热化学方程式为CO(g)+NO2(g)=CO2(g)+NO(g)△H=-234 KJ/mol,
故答案为:CO(g)+NO2(g)=CO2(g)+NO(g)△H=-234 KJ/mol
(2)该反应是从正反应方向开始的,所以随着反应的进行,氨气的浓度逐渐增大,其含量也在不断升高,当反应达到平衡时达到最大值.此后,随着反应温度的升高,化学平衡逆向移动,氨气的浓度逐渐降低,其含量也在不断减少.由于T3比T2时少,说明T3的状态丙是已经达到平衡状态的.若三者都达到平衡状态.由于温度T1<T2<T3.升高温度,化学平衡向逆反应方向移动,氨气的质量分数降低.温度越高,逆向进行的程度越大,氨气质量分数越低,所以在都达到平衡状态时,氨气的质量分数最高的是甲.
Ⅰ、因为浓度变化量之比等于化学计量数之比,所以△c(H2)=3△c(N2)=3×(0.1-0.06 )mol/L=0.12mol/L,实验②平衡时H2的转化率为α(H2)=$\frac{氢气浓度的变化量}{氢气浓度的起始量}×100%$=$\frac{0.12}{0.26}×100%$=46.15%.
Ⅱ、根据图示的信息可知:②到达平衡的时间比①短,到达平衡时N2的浓度与①相同,化学平衡不移动,故②与①相比加了催化剂.
Ⅲ、根据三段式计算得到平衡时各物质的浓度
N2(g)+3H2(g)=2NH3(g)
起始浓度:0.1 0.26 0
转化浓度:0.1-0.08=0.02 0.02×3=0.06 0.02×2=0.04
平衡浓度:0.08 0.26-0.06=0.2 0.04
平衡常数K=$\frac{0.04^2}{0.08×0.2^3}$L2•mol-2=2.5L2•mol-2
故答案为:丙; 甲;46.15%;加入催化剂;2.5L2•mol-2;
(3)参与反应的n(铜)=$\frac{3.2g}{64g/mol}$=0.5mol,设生成的NO的物质的量为x,则NO2的物质的量也为x,氧化还原反应中得失电子总数相等,铜失去的电子总数=氮得到的电子总数,则有0.05mol×2=3x+x,x=0.025mol,NO的体积为0.025mol×22.4L/mol=0.56L,
故答案为:0.56.
点评 本题考查了热化学方程式的书写,化学平衡和氧化还原反应的规律,其中化学平的综合考查难度稍大.

 实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如表:
实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如表:| 化合物 | 相对分子质量 | 密度/g•cm-3 | 沸点/℃ | 溶解度g/l00g水 |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
①在50mL三颈烧瓶中投入几粒沸石,将18.5mL正丁醇和13.4mL冰醋酸(过量),3~4滴浓硫酸按一定顺序均匀混合,安装分水器(作用:实验过程中不断分离除去反应生成的水)、温度计及回流冷凝管.
②将分水器分出的酯层和反应液一起倒入分液漏斗中依次用水洗,10% Na2CO3洗,再水洗,最后转移至锥形瓶并干燥.
③将干燥后的乙酸正丁酯加入烧瓶中,常压蒸馏,收集馏分,得15.1g乙酸正丁酯.
请回答有关问题:
(1)写出任意一种正丁醇同类的同分异构体的结构简式CH3CH2CH(OH)CH3.
(2)仪器A中发生反应的化学方程式为CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O.
(3)步骤①向三颈烧瓶中依次加入的药品是:正丁醇,浓硫酸,冰醋酸.
(4)步骤②中,用 10%Na2CO3溶液洗涤有机层,该步操作的目的是除去酯中混有的乙酸和正丁醇.
(5)步骤③在进行蒸馏操作时,若从118℃开始收集馏分,产率偏高,(填“高”或“低”)原因是会收集到少量未反应的冰醋酸和正丁醇.
(6)该实验生成的乙酸正丁酯的产率是65%.
| A. | 节日期间,在任意场所燃放烟花爆竹 | |
| B. | 实验时,将水倒入浓硫酸配置稀硫酸 | |
| C. | 煤矿矿井,必须通风,严禁烟火 | |
| D. | 用点燃的火柴在液化气钢瓶口检验是否漏气 |
| A. | 28g乙烯与丙烯的混合气体中含有双键数目为NA | |
| B. | 标准状况下,22.4L甘油中含有羟基的数目为3NA | |
| C. | 1L0.1mol•L-1NaHS溶液中,HS-与S2-数目之和为0.1 NA | |
| D. | 0.2molCl2与0.1molCH4充分反应,生成HCl分子数为0.2 NA |
| A. | 清晨,在茂密的树林,常常可以看到从枝叶间透过的一道道光柱 | |
| B. | 一支钢笔使用两种不同牌号的蓝黑墨水,易出现堵塞 | |
| C. | 在饱和FeCl3溶液中逐滴加入NaOH溶液,产生红褐色沉淀 | |
| D. | 在河水与海水交界处有三角洲形成 |
| A. | Al2O3 | B. | Fe2O3 | C. | Al(OH)3 | D. | Fe(OH)3 |
| A. | 氢原子的结构示意图为: ;则反氢原子的结构示意图为: ;则反氢原子的结构示意图为: | |
| B. | 反氢原子中有一个带负电荷的反质子和一个带正电荷的反电子 | |
| C. | 反氢原子的摩尔质量为1g/mol | |
| D. | 21H的反氢原子中有2个带负电荷的反质子 |