题目内容
6.下列现象或应用中,不能用胶体知识解释的是( )| A. | 清晨,在茂密的树林,常常可以看到从枝叶间透过的一道道光柱 | |
| B. | 一支钢笔使用两种不同牌号的蓝黑墨水,易出现堵塞 | |
| C. | 在饱和FeCl3溶液中逐滴加入NaOH溶液,产生红褐色沉淀 | |
| D. | 在河水与海水交界处有三角洲形成 |
分析 胶体是分散质介于1-100nm的分散系,胶体具有丁达尔效应,能够发生电泳,产生据此,胶体能够透过滤纸但是不能够通过半透膜,据此解答.
解答 解:A.清晨,在茂密的树林,常常可以看到从枝叶间透过的一道道光柱,属于胶体的丁达尔效应,故A正确;
B.墨水属于胶体,两种不同品牌和型号的墨水可能是两种带不同电荷的胶体,故混合后会发生聚沉,故B正确;
C.FeCl3溶液中逐滴加入NaOH溶液,发生复分解反应生成氢氧化铁沉淀,与胶体性质无关,故C错误;
D.河水是胶体,在入海口处遇到海水即电解质溶液会发生胶体的聚沉,和胶体的性质有关,故D正确.
故选C.
点评 本题考查胶体的性质,要求学生熟记教材中提到的胶体的例子,是对基础内容的考查,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
16.CoCl2•6H2O是一种饲料营养强化剂.一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2•6H2O的工艺流程如下: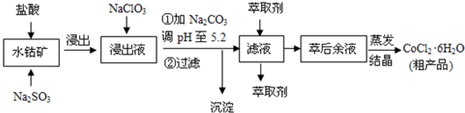
已知:
①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
③CoCl2•6H2O熔点为86℃,加热至110-120℃时,失去结晶生成无水氯化钴.
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O
写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O.
不慎向“浸出液”中加了过量NaClO3,可能会生成有毒气体.写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加加Na2CO3调pH至a”,过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3.加入萃取剂的目的是除去溶液中的Mn2+,防止Co2+转化为Co(OH)2沉淀.
(4)制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(5)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量HNO3酸化的AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水(答一条即可).

已知:
①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 |
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O
写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O.
不慎向“浸出液”中加了过量NaClO3,可能会生成有毒气体.写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加加Na2CO3调pH至a”,过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3.加入萃取剂的目的是除去溶液中的Mn2+,防止Co2+转化为Co(OH)2沉淀.
(4)制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(5)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量HNO3酸化的AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水(答一条即可).
17.下列有关有机物的说法正确的是( )
| A. | 苯、氯乙烯、丙烯分子中所有原子均在同一平面 | |
| B. | 汽油、柴油、植物油都是碳氢化合物 | |
| C. | 2-甲基丁烷也称异丁烷 | |
| D. | 乙醇、甲苯和溴苯可用水鉴别 |
1.在给定的条件下,下列选项所示的物质间转化均能实现的是( )
| A. | NH3$→_{催化剂,△}^{O_{2}}$NO$\stackrel{NaOH(aq)}{→}$NaNO2 | |
| B. | Fe2O3$→_{高温}^{Al}$Fe$→_{点燃}^{Cl_{2}}$FeCl3 | |
| C. | SiO2$→_{△}^{H_{2}O}$H2SiO3(aq)$\stackrel{NaOH(aq)}{→}$Na2SiO3 | |
| D. | CuCl2(aq)$\stackrel{NaOH(aq)}{→}$Cu(OH)2$→_{△}^{蔗糖(aq)}$Cu2O |
11.下列反应的离子方程式中,书写正确的是( )
| A. | 铁粉跟稀硫酸反应Fe+2H+=Fe2++H2↑ | |
| B. | 氧化铝和稀硫酸反应 O2-+2H+=H2O | |
| C. | 氢氧化钡溶液跟稀硫酸反应 Ba2++SO42-=BaSO4↓ | |
| D. | 铜与硝酸银溶液反应:Cu+Ag+═Ag+Cu2+ |
18.铝镁合金因坚硬、轻巧、美观、洁净、易于加工而成为新型建筑装潢材料,主要有于制作窗框、卷帘门、防护栏等.下列与这些用途无关的性质是( )
| A. | 导电性好 | B. | 不易生锈 | C. | 光泽度好 | D. | 强度高 |
15.下列说法正确的是( )
| A. | 可用物质的量表示分子、原子、离子、米粒等微粒或小颗粒物质 | |
| B. | 摩尔是国际单位制中的七个基本物理量之一 | |
| C. | 1mol任何物质都含有 6.02×1023个原子 | |
| D. | 0.012Kg12C所含碳原子数为6.02×1023 |
1.由氢气和氧气反应生成1mol水蒸气放出241.8kJ的热量,1mol水蒸气转化为液态水放出4.5kJ的热量,则下列热化学方程式书写正确的是( )
| A. | H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.9kJ/mol | B. | H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-241.8kJ/mol | ||
| C. | H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=+285.9kJ/mol | D. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=+241.8kJ/mol |