题目内容
2.下列行为中,符合安全要求的是( )| A. | 节日期间,在任意场所燃放烟花爆竹 | |
| B. | 实验时,将水倒入浓硫酸配置稀硫酸 | |
| C. | 煤矿矿井,必须通风,严禁烟火 | |
| D. | 用点燃的火柴在液化气钢瓶口检验是否漏气 |
分析 A.在任意场所燃放烟花爆竹,易发生火灾;
B.稀释浓硫酸,应防止酸液飞溅;
C.煤矿矿井含有甲烷,应防止爆炸;
D.易发生火灾或爆炸.
解答 解:A.在任意场所燃放烟花爆竹,易发生火灾,应避免在建筑物、易燃物的地方燃放,故A错误;
B.稀释浓硫酸,应防止酸液飞溅,可将浓硫酸沿烧杯内壁缓缓倒入水中,并用玻璃棒不断搅拌,故B错误;
C.煤矿矿井含有甲烷,应防止爆炸,应注意通风,以降低浓度,故C正确;
D.用点燃的火柴在液化气钢瓶口检验是否漏气,易发生火灾或爆炸,故D错误.
故选C.
点评 本题考查较为综合,涉及实验操作的安全性的评价,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握实验的严密性和可行性的评价,难度不大.

练习册系列答案
相关题目
13. Ⅰ.(1)某学习小组用0.80mol/L标准浓度的氢氧化钠溶液测定未知浓度的盐酸.
Ⅰ.(1)某学习小组用0.80mol/L标准浓度的氢氧化钠溶液测定未知浓度的盐酸.
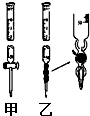
①滴定管如图所示,用甲(填“甲”或“乙”)滴定管盛待测定的未知浓度的盐酸.
②用滴定的方法来测定盐酸的浓度,实验数据如下所示:
该未知盐酸的浓度为0.92mol•L-1(保留两位有效数字).
(2)若用酚酞作指示剂,达到滴定终点的标志是无色变浅红色且30s不变色
(3)以下操作可能造成测定结果偏高的是BC
A.盛装待测液的锥形瓶用水洗后未干燥
B.滴定前,碱式滴定管尖端有气泡,滴定后气泡消失
C.碱式滴定管用蒸馏水洗净后,未用标准氢氧化钠溶液润洗
D.读碱式滴定管的刻度时,滴定前仰视凹液面最低处,滴定后俯视读数
Ⅱ.为了测定某氯化锶(SrCl2)样品的纯度,探究活动小组同学设计了如下方案:
称取1.0g样品溶解于适量水中,向其中加入含AgNO3 2.38g的AgNO3溶液(溶液中除Cl-外,不含其他与Ag+反应生成沉淀的离子),Cl-即被全部沉淀.然后用含Fe3+的溶液作指示剂,用0.2mol•L-1的NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+以AgSCN白色沉淀的形式析出,以测定氯化锶样品的纯度.
请回答下列问题:
(1)含Fe3+的溶液作指示剂达到滴定终点时发生颜色变化的离子方程式Fe3++3SCN-?Fe(SCN)3.
(2)在终点到达之前的滴定过程中,两种沉淀表面会吸附部分Ag+,需不断剧烈摇动锥形瓶,否则会使n(Cl-)的测定结果偏高(选填“偏高”“偏低”或“无影响”).
 Ⅰ.(1)某学习小组用0.80mol/L标准浓度的氢氧化钠溶液测定未知浓度的盐酸.
Ⅰ.(1)某学习小组用0.80mol/L标准浓度的氢氧化钠溶液测定未知浓度的盐酸.①滴定管如图所示,用甲(填“甲”或“乙”)滴定管盛待测定的未知浓度的盐酸.
②用滴定的方法来测定盐酸的浓度,实验数据如下所示:
| 实验编号 | 待测盐酸溶液的体积/mL | 滴入NaOH溶液的体积/mL |
| 1 | 20.00 | 23.00 |
| 2 | 20.00 | 23.10 |
| 3 | 20.00 | 22.90 |
(2)若用酚酞作指示剂,达到滴定终点的标志是无色变浅红色且30s不变色
(3)以下操作可能造成测定结果偏高的是BC
A.盛装待测液的锥形瓶用水洗后未干燥
B.滴定前,碱式滴定管尖端有气泡,滴定后气泡消失
C.碱式滴定管用蒸馏水洗净后,未用标准氢氧化钠溶液润洗
D.读碱式滴定管的刻度时,滴定前仰视凹液面最低处,滴定后俯视读数
Ⅱ.为了测定某氯化锶(SrCl2)样品的纯度,探究活动小组同学设计了如下方案:
称取1.0g样品溶解于适量水中,向其中加入含AgNO3 2.38g的AgNO3溶液(溶液中除Cl-外,不含其他与Ag+反应生成沉淀的离子),Cl-即被全部沉淀.然后用含Fe3+的溶液作指示剂,用0.2mol•L-1的NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+以AgSCN白色沉淀的形式析出,以测定氯化锶样品的纯度.
请回答下列问题:
(1)含Fe3+的溶液作指示剂达到滴定终点时发生颜色变化的离子方程式Fe3++3SCN-?Fe(SCN)3.
(2)在终点到达之前的滴定过程中,两种沉淀表面会吸附部分Ag+,需不断剧烈摇动锥形瓶,否则会使n(Cl-)的测定结果偏高(选填“偏高”“偏低”或“无影响”).
17.下列有关有机物的说法正确的是( )
| A. | 苯、氯乙烯、丙烯分子中所有原子均在同一平面 | |
| B. | 汽油、柴油、植物油都是碳氢化合物 | |
| C. | 2-甲基丁烷也称异丁烷 | |
| D. | 乙醇、甲苯和溴苯可用水鉴别 |
7.在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
(1)写出该反应的平衡常数表达式:K=$\frac{c^2(N{O}_{2})}{c^2(NO)•c({O}_{2})}$;若其他条件不变,容器体积缩小为1L,则K值不变.(增大、减小或不变);若K300°C>K350°C,则该反应是放热反应.
(2)用O2表示从0~2s内该反应的平均速率v=1.5×10-3mol•L-1•s-1;
(3)能说明该反应已达到平衡状态的是bcd.
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是c.
a.及时分离除NO2气体
b.适当升高温度
c.增大O2的浓度
d.选择高效催化剂.
| 时间(s) | 0 | 1 | 2 | 3 | 4 |
| n(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 |
(2)用O2表示从0~2s内该反应的平均速率v=1.5×10-3mol•L-1•s-1;
(3)能说明该反应已达到平衡状态的是bcd.
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是c.
a.及时分离除NO2气体
b.适当升高温度
c.增大O2的浓度
d.选择高效催化剂.
11.下列反应的离子方程式中,书写正确的是( )
| A. | 铁粉跟稀硫酸反应Fe+2H+=Fe2++H2↑ | |
| B. | 氧化铝和稀硫酸反应 O2-+2H+=H2O | |
| C. | 氢氧化钡溶液跟稀硫酸反应 Ba2++SO42-=BaSO4↓ | |
| D. | 铜与硝酸银溶液反应:Cu+Ag+═Ag+Cu2+ |
12.分类是化学学习和研究的常用手段,下列分类依据和结论都正确的是( )
| A. | 四氯化碳-非电解质 氯化银-强电解质 碳酸-弱电解质 | |
| B. | NO2-酸性氧化物 CuO-碱性氧化物 Al2O3-两性氧化物 | |
| C. | 冰醋酸、纯碱、芒硝、生石灰分别属于酸、碱、盐、氧化物 | |
| D. | 碘酒、淀粉溶液、水雾、纳米材料均为胶体 |