题目内容
15.mg某气体,它由双原子分子构成,它的摩尔质量为Mg•mol-1.若阿伏加德罗常数用NA表示,则:(1)该气体的物质的量为$\frac{m}{M}$mol.
(2)该气体所含原子总数为$\frac{2m{N}_{A}}{M}$个.
(3)该气体在标准状况下的体积为$\frac{22.4m}{M}$L.
(4)该气体溶于1L水中(不考虑反应),其溶液中溶质的质量分数为$\frac{m}{m+1000}$×100%.
(5)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为=$\frac{m}{MV}$g•mol-1.
(6)STP,V L该气体中含有N个分子,则阿伏加德罗常数可表示为$\frac{22.4N}{V}$.
分析 (1)依据n=$\frac{m}{M}$计算;
(2)依据n=$\frac{m}{M}$=$\frac{N}{N{\;}_{A}}$计算;
(3)依据V=nVm计算;
(4)依据ω=$\frac{溶质的质量}{溶液的质量}$×100%计算;
(5)依据c=$\frac{n}{V}$计算;
(6)依据n=$\frac{m}{M}$=$\frac{N}{N{\;}_{A}}$计算解答.
解答 (1)mg某气体,物质的量为:$\frac{m}{M}$;
故答案为:$\frac{m}{M}$;
(2)mg某气体,它由双原子分子构成,该气体所含原子总数为:$\frac{m}{M}$×NA×2=$\frac{2mN{\;}_{A}}{M}$;
故答案为:$\frac{2mN{\;}_{A}}{M}$;
(3)该气体在标准状况下的体积为:$\frac{m}{M}$×22.4L/mol=$\frac{22.4m}{M}$;
故答案为:$\frac{22.4m}{M}$;
(4)该气体溶于1L水中(不考虑反应),其溶液中溶质的质量分数为:$\frac{m}{m+1000}$×100%;
故答案为:$\frac{m}{m+1000}$×100%;
(5)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为:$\frac{n}{V}$=$\frac{m}{MV}$;
故答案为:$\frac{m}{MV}$;
(6)STP,V L该气体中含有N个分子,即$\frac{V}{22.4}$×NA=N,则NA=$\frac{22.4N}{V}$;
故答案为:$\frac{22.4N}{V}$.
点评 本题考查了物质的量有关计算,熟悉以物质的量为核心计算公式是解题关键,题目难度不大.

练习册系列答案
相关题目
1.能正确表示下列反应的离子方程式是( )
| A. | 稀盐酸与铁屑反应:2Fe+6H+=2Fe3++3H2↑ | |
| B. | 钠与硝酸铜溶液反应:2Na+Cu2+=Cu+2Na+ | |
| C. | KHCO3溶液与稀H2SO4反应:CO32-+2H+=H2O+CO2↑ | |
| D. | 醋酸钠水解:CH3COO-+H2O?CH3COOH+OH- |
5.化学与社会、生产、生活密切相关.下列说法正确的是( )
| A. | 明矾、漂白粉、臭氧的净水原理相同 | |
| B. | 用鸡蛋壳膜和蒸馏水除去淀粉胶体中的食盐不涉及化学变化 | |
| C. | 煤的干馏和石油的分馏都属于物理变化 | |
| D. | 亚硝酸钠是一种食品防腐剂,使用时其用量可以不加限制 |

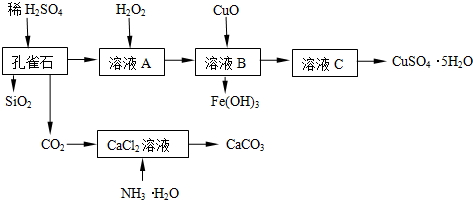
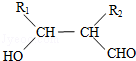
 .
.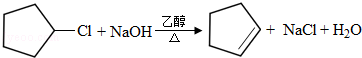 .
.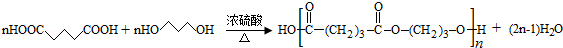 .
.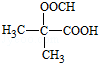 (写构简式)
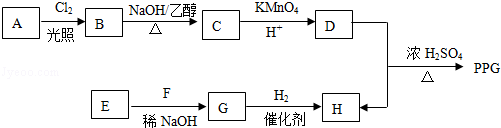
(写构简式) COOCH2CH2CH(OH3)2.合成路线如下:
COOCH2CH2CH(OH3)2.合成路线如下: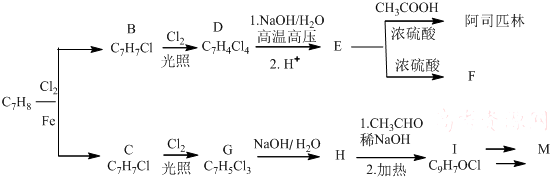
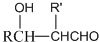 $\stackrel{加热}{→}$H2O+
$\stackrel{加热}{→}$H2O+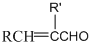
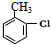 ,由H生成I的第二步反应的反应类型是消去反应.
,由H生成I的第二步反应的反应类型是消去反应.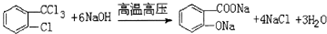 .E→F
.E→F .
.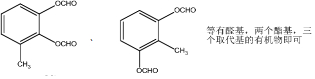 .
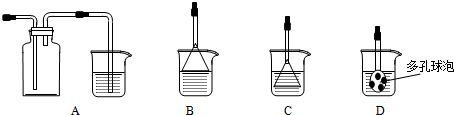
.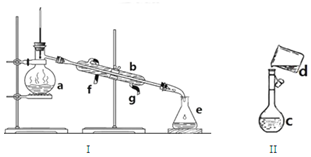 掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置.
掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置.