题目内容
10.足量浓硫酸与mg铜反应得到标准状况下SO2nL,则被还原的酸是( )| A. | $\frac{m}{32}$ mol | B. | $\frac{2m}{64}$ mol | C. | $\frac{98n}{22.4}$ g | D. | $\frac{64n}{22.4}$g |
分析 由电子守恒可知,n(Cu)×(2-0)=n(被还原的酸)×(6-4),由原子守恒可知,n(被还原的酸)=n(SO2),以此来解答.
解答 解:Cu与浓硫酸反应生成硫酸铜、二氧化硫和水,
由电子守恒可知,n(Cu)×(2-0)=n(被还原的酸)×(6-4),则n(被还原的酸)=$\frac{m}{64}$mol,其质量为$\frac{m}{64}$mol×98g/mol;
由原子守恒可知,n(被还原的酸)=n(SO2),则n(被还原的酸)=$\frac{n}{22.4}$mol,其质量为$\frac{98n}{22.4}$ g,
故选C.
点评 本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化、电子及原子守恒为解答的关键,侧重分析与计算能力的考查,注意守恒法应用,题目难度不大.

练习册系列答案
相关题目
1.在下列溶液中,各组离子一定能够大量共存的是( )
| A. | 使酚酞溶液变红的溶液:H+、C1-、NO3-、Ba2+ | |
| B. | 澄清透明的溶液:MnO4-、Al3+、SO42-、K+ | |
| C. | 强碱性溶液:K+、Mg2+、HCO3-、NO3- | |
| D. | 无色的溶液:CO32-、SO42-、Cu2+、NH4+ |
5.化学与社会、生产、生活密切相关.下列说法正确的是( )
| A. | 明矾、漂白粉、臭氧的净水原理相同 | |
| B. | 用鸡蛋壳膜和蒸馏水除去淀粉胶体中的食盐不涉及化学变化 | |
| C. | 煤的干馏和石油的分馏都属于物理变化 | |
| D. | 亚硝酸钠是一种食品防腐剂,使用时其用量可以不加限制 |
2.关于下列各装置图的叙述中,正确的是( )
| A. | 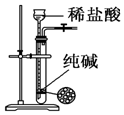 用图装置制取少量CO2气体 | |
| B. | 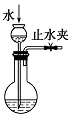 图可检查该装置的气密性 | |
| C. | 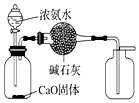 用图装置制取并收集干燥的NH3 | |
| D. | 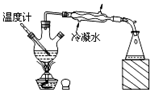 装置可分离沸点不同且互溶的液体混合物 |
20. 生产上用过量烧碱溶液处理某矿物(含Al2O3、MgO),过滤后得到滤液用NaHCO3溶液处理,测得溶液pH和Al(OH)3生成的量随加入NaHCO3溶液体积变化的曲线如下:下列有关说法不正确的是( )
生产上用过量烧碱溶液处理某矿物(含Al2O3、MgO),过滤后得到滤液用NaHCO3溶液处理,测得溶液pH和Al(OH)3生成的量随加入NaHCO3溶液体积变化的曲线如下:下列有关说法不正确的是( )
 生产上用过量烧碱溶液处理某矿物(含Al2O3、MgO),过滤后得到滤液用NaHCO3溶液处理,测得溶液pH和Al(OH)3生成的量随加入NaHCO3溶液体积变化的曲线如下:下列有关说法不正确的是( )
生产上用过量烧碱溶液处理某矿物(含Al2O3、MgO),过滤后得到滤液用NaHCO3溶液处理,测得溶液pH和Al(OH)3生成的量随加入NaHCO3溶液体积变化的曲线如下:下列有关说法不正确的是( )| A. | NaHCO3溶液的物质的量浓度为0.8 mol/L | |
| B. | b点与c点溶液所含微粒种类相同 | |
| C. | a点溶液中存在的离子是Na+、AlO2-、OH-、H+ | |
| D. | 生成沉淀的离子方程式为:HCO3-+AlO2-+H2O═Al(OH)3↓+CO32- |
 COOCH2CH2CH(OH3)2.合成路线如下:
COOCH2CH2CH(OH3)2.合成路线如下: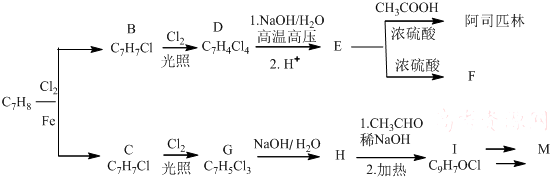
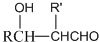 $\stackrel{加热}{→}$H2O+
$\stackrel{加热}{→}$H2O+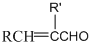
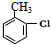 ,由H生成I的第二步反应的反应类型是消去反应.
,由H生成I的第二步反应的反应类型是消去反应.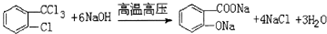 .E→F
.E→F .
.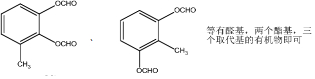 .
. 用胆矾晶体(CuSO4•5H2O )配制0.40mol/L的CuSO4溶液240mL,回答下列问题
用胆矾晶体(CuSO4•5H2O )配制0.40mol/L的CuSO4溶液240mL,回答下列问题