题目内容
NA代表阿伏加德罗常数.下列叙述正确的是( )
| A、常温常压下的33.6L氯气与27g铝充分反应,转移电子数为3NA |
| B、由CO和O2组成的混台物中共有NA个分子,其中的氧原子数为2NA |
| C、在H2O2+Cl2=2HCl+O2反应中,每生成32g氧气,转移电子数为2NA个 |
| D、0.1mol Fe粉与足量水蒸气反应生成的H2分子数为0.1NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.常温常压下,不能使用标况下的气体摩尔体积计算氯气的物质的量;
B.一氧化碳和氧气中含有的氧原子数目不相等,无法计算混合物中含有的氧原子数目;
C.双氧水中氧元素化合价为-1价,生成1mol氧气转移了2mol电子;
D.铁与水蒸气反应生成产物为四氧化三铁,1mol铁完全反应失去
mol电子,生成氢气
mol.
B.一氧化碳和氧气中含有的氧原子数目不相等,无法计算混合物中含有的氧原子数目;
C.双氧水中氧元素化合价为-1价,生成1mol氧气转移了2mol电子;
D.铁与水蒸气反应生成产物为四氧化三铁,1mol铁完全反应失去
| 8 |
| 3 |
| 4 |
| 3 |
解答:
解:A.不是标准状况下,题中条件无法计算33.6L氯气的物质的量,故A错误;
B.NA个分子的物质的量为1mol,由于一氧化碳和氧气中含有的氧原子数目不同,所以无法计算化合物中含有的氧原子数目,故B错误;
C.在H2O2+Cl2=2HCl+O2反应中,双氧水中氧元素化合价为-1价,生成1mol氧气转移了2mol电子,32g氧气的物质的量为1mol,因此转移了2mol电子,转移电子数为2NA,故C正确;
D.0.1mol Fe粉与足量水蒸气反应,0.1mol铁完全反应失去
mol电子,生成氢气
mol,生成的H2分子数为
NA,故D错误;
故选C.
B.NA个分子的物质的量为1mol,由于一氧化碳和氧气中含有的氧原子数目不同,所以无法计算化合物中含有的氧原子数目,故B错误;
C.在H2O2+Cl2=2HCl+O2反应中,双氧水中氧元素化合价为-1价,生成1mol氧气转移了2mol电子,32g氧气的物质的量为1mol,因此转移了2mol电子,转移电子数为2NA,故C正确;
D.0.1mol Fe粉与足量水蒸气反应,0.1mol铁完全反应失去
| 0.8 |
| 3 |
| 0.4 |
| 3 |
| 2 |
| 15 |
故选C.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系;选项D为易错点,注意四氧化三铁中铁元素的化合价情况.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
下列反应的离子方程式书写正确的是( )
| A、碳酸钙与醋酸反应:CO32-+2H+=CO2↑+H2O |
| B、铁片与盐酸反应:2Fe+6H+=2Fe3++3H2↑ |
| C、氯化铝溶液与氨水反应:Al3++4OH-=AlO2-+2H2O |
| D、氢氧化钡溶液与稀硫酸反应:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O |
X、Y、Z是周期表中相邻的三种短周期元素,它们原子半径依次减小,X与Z的核电荷数之比为3:4,X、Y、Z分别与氢元素形成氢化物.下列叙述正确的是( )
| A、Z是第二周期ⅣA族元素 |
| B、最高价氧化物对应的水化物的酸性:Y<X |
| C、非金属性:X<Y<Z |
| D、X、Y、Z的氢化物稳定性逐渐减弱 |
在无色透明碱性溶液中,能共存的离子组是( )
| A、Na+、CO32-、SO42-、Fe2+ |
| B、MnO4-、K+、SO42-、Na+ |
| C、K+、SO42-、HCO3-、Na+ |
| D、Ba2+、NO3-、Cl-、Na+ |
下列各组离子能大量共存的是( )
| A、NH4+、Na+、NO3-、OH- |
| B、Ca2+、Na+、Cl-、CO32- |
| C、K+、H+、SO42-、OH- |
| D、Na+、K+、OH-、Cl- |
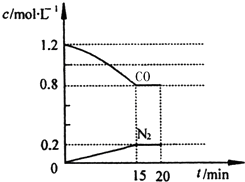 新近出版的《前沿科学》杂志刊发的中国环境科学研究院研究员的论文《汽车尾气污染及其危害》,其中系统地阐述了汽车尾气排放对大气环境及人体健康造成的严重危害.目前降低尾气的可行方法是在汽车排气管上安装催化转化器.NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生反应:
新近出版的《前沿科学》杂志刊发的中国环境科学研究院研究员的论文《汽车尾气污染及其危害》,其中系统地阐述了汽车尾气排放对大气环境及人体健康造成的严重危害.目前降低尾气的可行方法是在汽车排气管上安装催化转化器.NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生反应: 氯气常用于自来水厂杀菌消毒.
氯气常用于自来水厂杀菌消毒.

 电解原理在化学工业中有广泛的应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛的应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: