题目内容
11.下列关于葡萄糖的说法中,错误的是( )| A. | 葡萄糖的分子式是C6H12O6 | |
| B. | 葡萄糖是多羟基醛,因而具有醛和多元醇的性质 | |
| C. | 葡萄糖是最简单的醛糖 | |
| D. | 葡萄糖可以通过绿色植物光合作用合成 |
分析 1个葡萄糖分子含含6个C、6个H、6个O,含-OH、-CHO,为单糖,而核糖、脱氧核糖是醛糖且比葡萄糖简单,光合作用可合成葡萄糖,以此来解答.
解答 解:A.1个葡萄糖分子含含6个C、6个H、6个O,分子式是C6H12O6,故A正确;
B.含-OH、-CHO,具有醛和多元醇的性质,故B正确;
C.葡萄糖为单糖,但核糖、脱氧核糖是醛糖且比葡萄糖简单,故C错误;
D.绿色植物通过光合作用可以在光照条件下,将二氧化碳和水合成为葡萄糖,故D错误;
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握葡萄糖中含-OH、-CHO及醛糖的判断为解答的关键,侧重分析与应用能力的考查,注意选项C为解答的难点,题目难度不大.

练习册系列答案
相关题目
2.已知:相同温度下Ka(HF)>Ka(HCN).现有物质的量浓度和体积均相同的NaF和NaCN两种溶液,已知前者溶液中所含离子数目为n1,后者溶液中所含离子数目为n2,下列关系正确的是( )
| A. | 溶液pH:NaF>NaCN | B. | n1>n2 | ||
| C. | H2O的电离程度:NaF>NaCN | D. | c(F-)<c(CN-) |
19.下列实验方法正确的是( )
| A. | 用加热、蒸发的方法除去粗盐中的CaCl2、MgCl2等杂质 | |
| B. | 用过滤的方法除去NaCl溶液中含有的少量淀粉胶体 | |
| C. | 用溶解、过滤的方法提纯含有少量BaSO4的BaCO3 | |
| D. | 用丁达尔现象区分溶液与胶体 |
6.下列叙述正确的是( )
| A. | 1 mol H2SO4的质量是98 g/mol | |
| B. | CO2的摩尔质量等于CO2的相对分子质量 | |
| C. | 摩尔质量建立了物质的物质的量与物质的质量之间的联系 | |
| D. | 1 mol任何物质的质量等于该物质的相对分子质量 |
16.下列事实不能用勒夏特列原理解释的是( )
| A. | 光照新制的氯水时,溶液黄绿色变浅 | |
| B. | 高温高压有利于N2和H2转化为NH3:N2(g)+3H2(g)?2NH3(g);△H<0) | |
| C. | 打开汽水瓶时,有大量气泡逸出 | |
| D. | 氨水应密闭保存于低温处 |
3.现有三组溶液:①菜籽油和氯化钠溶液 ②75%的医用酒精 ③氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( )
| A. | 过滤 萃取 分液 | B. | 萃取 分液 蒸馏 | C. | 分液 蒸馏 萃取 | D. | 萃取 蒸馏 分液 |
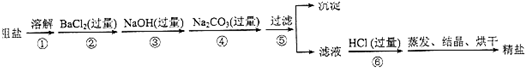
1.某课外小组设计的实验室制取乙酸乙酯的装置如图1所示,A中放有浓硫酸,B中放有乙醇(含18O)、无水醋酸钠,D中放有含有酚酞饱和碳酸钠溶液
已知①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH
②有关有机物的沸点:
请回答:
(1)浓硫酸的作用是制乙酸、催化剂、吸水剂并作催化剂、脱水剂;若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式:CH3COOH+CH3CH218OH$?_{△}^{浓硫酸}$CH3CO18OC2H5+H2O
(2)球形干燥管C的作用是冷凝和防止倒吸、冷凝.反应结束后D中的现象是液体分层,溶液分层,上层无色油体液体,下层溶液颜色变浅
(3)上述实验中饱和碳酸钠溶液的作用是中和乙酸并吸收乙醇,减少乙酸乙酯的溶解
(4)欲从D中得到乙酸乙酯的分离方法是分液;从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入生石灰,并用蒸馏法分离出乙醇,再用法除去乙醚,而得到纯净的乙酸乙酯
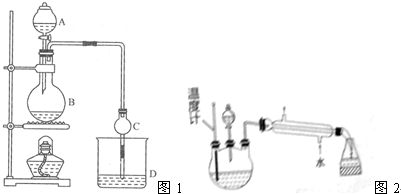
(5)某化学课外小组设计了如图2所示的制取乙酸乙酯的装置(图中的铁架台、铁夹,加热装置已略去),与上如图装置相比,此装置的主要优点有(填写处两点)①增加了温度计,便于控制发生装置中反应液的温度,减少副产物的发生,②增加了冷凝装置,有利于收集产物乙酸乙酯
已知①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH
②有关有机物的沸点:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
(1)浓硫酸的作用是制乙酸、催化剂、吸水剂并作催化剂、脱水剂;若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式:CH3COOH+CH3CH218OH$?_{△}^{浓硫酸}$CH3CO18OC2H5+H2O
(2)球形干燥管C的作用是冷凝和防止倒吸、冷凝.反应结束后D中的现象是液体分层,溶液分层,上层无色油体液体,下层溶液颜色变浅
(3)上述实验中饱和碳酸钠溶液的作用是中和乙酸并吸收乙醇,减少乙酸乙酯的溶解
(4)欲从D中得到乙酸乙酯的分离方法是分液;从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入生石灰,并用蒸馏法分离出乙醇,再用法除去乙醚,而得到纯净的乙酸乙酯
(5)某化学课外小组设计了如图2所示的制取乙酸乙酯的装置(图中的铁架台、铁夹,加热装置已略去),与上如图装置相比,此装置的主要优点有(填写处两点)①增加了温度计,便于控制发生装置中反应液的温度,减少副产物的发生,②增加了冷凝装置,有利于收集产物乙酸乙酯

2. 现用邻苯二甲酸氢钾标准溶液来测定NaOH溶液的浓度.用氢氧化钠溶液来滴定邻苯二甲酸溶液时有下列操作:
现用邻苯二甲酸氢钾标准溶液来测定NaOH溶液的浓度.用氢氧化钠溶液来滴定邻苯二甲酸溶液时有下列操作:
①向溶液中加入1~2滴指示剂 ②取20mL标准溶液放入锥形瓶中
③用氢氧化钠溶液滴定至终点 ④重复以上操作
⑤用天平精确称取5.105g邻苯二甲酸氢钾(相对分子质量为204.2)固体配成250mL标准溶液(测得pH约为4.2).
⑥根据实验数据计算氢氧化钠的物质的量浓度.
(1)以上各步中,正确的(填序号)操作顺序是⑤②①③④⑥,上述②中使用的仪器除锥形瓶外,还需要使用的仪器是酸式滴定管.选用指示剂是:酚酞
(2)滴定,并记录NaOH的终读数.重复滴定几次,数据记录如下表:
某同学在处理数据过程中计算得到平均消耗NaOH溶液的体积为:
V(NaOH)=$\frac{19.98+20.00+20.80+20.02}{4}$20.20mL,他的计算合理吗?理由是不合理;第3组数据和其他三组相差较大,不应采用
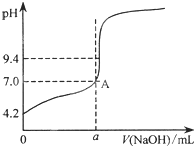
通过仪器测得第4次滴定过程中溶液pH随加入氢 氧化钠溶液体积的变化曲线如图所示,则a<20.02(填“>”、“<”或“=”)
(3)步骤②中在观察滴定管的起始读数时,要使滴定管的尖嘴部分充满溶液,如果滴定管内部有气泡,赶走气泡的操作快速放液.
(4)滴定前,用蒸馏水洗净碱式滴定管,然后加待测定的氢氧化钠溶液滴定,此操作对实验结果偏小(填“偏大”、“偏小”或“无影响”)
 现用邻苯二甲酸氢钾标准溶液来测定NaOH溶液的浓度.用氢氧化钠溶液来滴定邻苯二甲酸溶液时有下列操作:
现用邻苯二甲酸氢钾标准溶液来测定NaOH溶液的浓度.用氢氧化钠溶液来滴定邻苯二甲酸溶液时有下列操作:①向溶液中加入1~2滴指示剂 ②取20mL标准溶液放入锥形瓶中
③用氢氧化钠溶液滴定至终点 ④重复以上操作
⑤用天平精确称取5.105g邻苯二甲酸氢钾(相对分子质量为204.2)固体配成250mL标准溶液(测得pH约为4.2).
⑥根据实验数据计算氢氧化钠的物质的量浓度.
(1)以上各步中,正确的(填序号)操作顺序是⑤②①③④⑥,上述②中使用的仪器除锥形瓶外,还需要使用的仪器是酸式滴定管.选用指示剂是:酚酞
(2)滴定,并记录NaOH的终读数.重复滴定几次,数据记录如下表:
| 滴定次数 实验数据 | 1 | 2 | 3 | 4 |
| V(样品)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)/mL(初读数) | 0.10 | 0.30 | 0.00 | 0.20 |
| V(NaOH)/mL(终读数) | 20.08 | 20.30 | 20.80 | 20.22 |
| V(NaOH)/mL(消耗) | 19.98 | 20.00 | 20.80 | 20.02 |
V(NaOH)=$\frac{19.98+20.00+20.80+20.02}{4}$20.20mL,他的计算合理吗?理由是不合理;第3组数据和其他三组相差较大,不应采用
通过仪器测得第4次滴定过程中溶液pH随加入氢 氧化钠溶液体积的变化曲线如图所示,则a<20.02(填“>”、“<”或“=”)
(3)步骤②中在观察滴定管的起始读数时,要使滴定管的尖嘴部分充满溶液,如果滴定管内部有气泡,赶走气泡的操作快速放液.
(4)滴定前,用蒸馏水洗净碱式滴定管,然后加待测定的氢氧化钠溶液滴定,此操作对实验结果偏小(填“偏大”、“偏小”或“无影响”)