题目内容
7.下列反应的离子方程式书写正确的是( )| A. | 用稀硫酸清洗铁锈(Fe2O3):Fe2O3+6H+═2Fe3++3H2O | |
| B. | 铝片与硝酸汞溶液反应:Al+Hg2+═Al3++Hg | |
| C. | 硫酸铜溶液和氢氧化钡溶液混合:Ba2++SO42-═BaSO4↓ | |
| D. | 碳酸氢钙溶液跟盐酸反应:Ca(HCO3)2+2H+═Ca2++2H2O+2CO2↑ |
分析 A.二者反应生成硫酸铁和水;
B.电荷不守恒;
C.漏掉铜离子与氢氧根离子的反应;
D.碳酸氢钙为易溶性盐,应拆成离子形式.
解答 解:A.用稀硫酸清洗铁锈(Fe2O3),离子方程式:Fe2O3+6H+═2Fe3++3H2O,故A正确;
B.铝片与硝酸汞溶液反应,离子方程式:2Al+3Hg2+═2Al3++3Hg,故B错误;
C.硫酸铜溶液和氢氧化钡溶液混合,离子方程式:Cu2++2OH-+Ba2++SO42-═BaSO4↓+Cu(OH)2↓,故C错误;
D.碳酸氢钙溶液跟盐酸反应:HCO3-+H+═H2O+CO2↑,故D错误;
故选:A.
点评 本题考查了离子方程式的书写,明确反应的实质是解题关键,离子方程式书写应遵循客观规律、遵循电荷守恒、原子个数守恒规律,注意化学式的拆分,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
17.过氧化镁(MgO2)为白色粉末,不溶于水,易溶于稀酸,主要用于医药等行业.MgO2可以下反应制得:MgO2+H2O=═MgO2+H2O
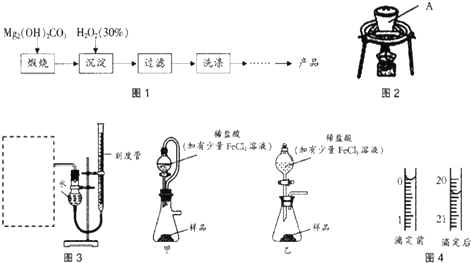
Ⅰ过氧化镁的制备
过氧化镁的制备流程如图1所示:
(1)用如图2所示装置进行煅烧,仪器A的名称是坩埚;
(2)某同学为了研究Mg2(OH)2CO3煅烧条件对合成MgO2的影响.设计实验如下表所示(所取固体质量均为ag),其他条件不变时,探究煅烧温度对合成MgO2的影响,可选择实验①③(填实验编号).
Ⅱ过氧化镁晶体含量的测定:过氧化镁产品中常混有少量MgO,实验室可通过多种方案测定样品中过氧化镁的含量.
(3)某同学拟用图3装置测定一定质量的样品中过氧化镁的含量.
①图3装置中,虚线框内应选择装置甲(填“甲”或“乙”).②装置连接完毕后,进行气密性检验的方法为向量气管中加水到右端液面高出左端液面,若液面不发生变化,则气密性良好;③稀盐酸中加入少量FeCl3溶液作用是催化剂.
(4)某同学准确称取1.500g产品于锥形瓶中,加入15ml蒸馏水和15mL2.000mol•L-1 H2SO4,用0.5000mol•L-1KMnO4标准溶液滴定至终点.
反应的离子方程式为:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O
①滴定终点观察到的现象为当滴入最后一滴高锰酸钾溶液后溶液由无色变为浅红色,且30s不褪色;
②根据图4计算产品中MgO2的质量分数为95.2%.

Ⅰ过氧化镁的制备
过氧化镁的制备流程如图1所示:
(1)用如图2所示装置进行煅烧,仪器A的名称是坩埚;
(2)某同学为了研究Mg2(OH)2CO3煅烧条件对合成MgO2的影响.设计实验如下表所示(所取固体质量均为ag),其他条件不变时,探究煅烧温度对合成MgO2的影响,可选择实验①③(填实验编号).
| 实验编号 | 煅烧温度(℃) | 煅烧时间(h) |
| ① | 550 | 2 |
| ② | 600 | 1 |
| ③ | 650 | 2 |
| ④ | 700 | 3 |
(3)某同学拟用图3装置测定一定质量的样品中过氧化镁的含量.
①图3装置中,虚线框内应选择装置甲(填“甲”或“乙”).②装置连接完毕后,进行气密性检验的方法为向量气管中加水到右端液面高出左端液面,若液面不发生变化,则气密性良好;③稀盐酸中加入少量FeCl3溶液作用是催化剂.
(4)某同学准确称取1.500g产品于锥形瓶中,加入15ml蒸馏水和15mL2.000mol•L-1 H2SO4,用0.5000mol•L-1KMnO4标准溶液滴定至终点.
反应的离子方程式为:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O
①滴定终点观察到的现象为当滴入最后一滴高锰酸钾溶液后溶液由无色变为浅红色,且30s不褪色;
②根据图4计算产品中MgO2的质量分数为95.2%.
18.下列实验设计和结论相符的是( )
| A. | 将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中 | |
| B. | 某气体能使湿润的红色石蕊试纸变蓝,该气体水溶液一定显碱性 | |
| C. | 某无色溶液加Ba(NO3)2溶液,再加入稀盐酸,沉淀不溶解,则原溶液中一定有SO42- | |
| D. | 加入稀盐酸产生无色无味气体,将气体通入澄清石灰水中溶液变浑浊,一定有CO32- |
15.下列溶液中所含微粒种类最多的是( )
| A. | Na2HPO4溶液 | B. | NH4Cl溶液 | C. | CH3COONa溶液 | D. | NaHCO3溶液 |
2.已知:相同温度下Ka(HF)>Ka(HCN).现有物质的量浓度和体积均相同的NaF和NaCN两种溶液,已知前者溶液中所含离子数目为n1,后者溶液中所含离子数目为n2,下列关系正确的是( )
| A. | 溶液pH:NaF>NaCN | B. | n1>n2 | ||
| C. | H2O的电离程度:NaF>NaCN | D. | c(F-)<c(CN-) |
19.下列实验方法正确的是( )
| A. | 用加热、蒸发的方法除去粗盐中的CaCl2、MgCl2等杂质 | |
| B. | 用过滤的方法除去NaCl溶液中含有的少量淀粉胶体 | |
| C. | 用溶解、过滤的方法提纯含有少量BaSO4的BaCO3 | |
| D. | 用丁达尔现象区分溶液与胶体 |
16.下列事实不能用勒夏特列原理解释的是( )
| A. | 光照新制的氯水时,溶液黄绿色变浅 | |
| B. | 高温高压有利于N2和H2转化为NH3:N2(g)+3H2(g)?2NH3(g);△H<0) | |
| C. | 打开汽水瓶时,有大量气泡逸出 | |
| D. | 氨水应密闭保存于低温处 |
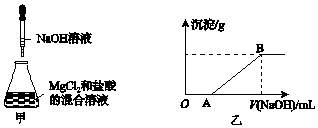
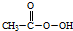 (过氧乙酸)+H2O
(过氧乙酸)+H2O