题目内容
8.在标准状况下,m g气体A与n g气体B分子数相等,下列说法不正确的是( )| A. | 标准状况下,同体积的气体A和气体B的质量比m:n | |
| B. | 25℃,101KPa时,1Kg气体A与1Kg气体B的分子数比为n:m | |
| C. | 同温同压下,气体A与气体B密度比为n:m | |
| D. | 标准状况下,等质量的A与B的体积比为n:m |
分析 在同温同压下,气体摩尔体积相等,mg A气体与ng B气体的分子数相等,说明二者的物质的量相等,根据n=$\frac{m}{M}$知,A、B的摩尔质量之比=其质量之比=m:n,结合m=$\frac{V}{{V}_{m}}$M、N=$\frac{m}{M}$NA、ρ=$\frac{M}{{V}_{m}}$、V=$\frac{m}{M}$Vm进行计算和判断.
解答 解:在同温同压下,气体摩尔体积相等,mg A气体与ng B气体的分子数相等,说明二者的物质的量相等,根据n=$\frac{m}{M}$知,A、B的摩尔质量之比=其质量之比=m:n,
A.相同条件下,根据m=$\frac{V}{{V}_{m}}$M可知,气体体积相等时,气体的质量与摩尔质量成正比,所以A、B的质量之比=m:n,故A正确;
B.根据N=$\frac{m}{M}$NA可知,相同质量时气体分子数之比等于摩尔质量反比=n:m,故B正确;
C.根据ρ=$\frac{M}{{V}_{m}}$可知,气体摩尔体积相等时,气体的密度之比等于其摩尔质量之比=m:n,故C错误;
D.根据V=$\frac{m}{M}$Vm可知,相同条件下,质量相等时气体体积之比等于摩尔质量反比=n:m,故D正确;
故选C.
点评 本题考查阿伏伽德罗定律及其推论,题目难度中等,试题侧重考查公式灵活运用,明确物质的量公式中各个物理量的关系是解本题关键,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
18.下列实验设计和结论相符的是( )
| A. | 将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中 | |
| B. | 某气体能使湿润的红色石蕊试纸变蓝,该气体水溶液一定显碱性 | |
| C. | 某无色溶液加Ba(NO3)2溶液,再加入稀盐酸,沉淀不溶解,则原溶液中一定有SO42- | |
| D. | 加入稀盐酸产生无色无味气体,将气体通入澄清石灰水中溶液变浑浊,一定有CO32- |
19.下列实验方法正确的是( )
| A. | 用加热、蒸发的方法除去粗盐中的CaCl2、MgCl2等杂质 | |
| B. | 用过滤的方法除去NaCl溶液中含有的少量淀粉胶体 | |
| C. | 用溶解、过滤的方法提纯含有少量BaSO4的BaCO3 | |
| D. | 用丁达尔现象区分溶液与胶体 |
16.下列事实不能用勒夏特列原理解释的是( )
| A. | 光照新制的氯水时,溶液黄绿色变浅 | |
| B. | 高温高压有利于N2和H2转化为NH3:N2(g)+3H2(g)?2NH3(g);△H<0) | |
| C. | 打开汽水瓶时,有大量气泡逸出 | |
| D. | 氨水应密闭保存于低温处 |
3.现有三组溶液:①菜籽油和氯化钠溶液 ②75%的医用酒精 ③氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( )
| A. | 过滤 萃取 分液 | B. | 萃取 分液 蒸馏 | C. | 分液 蒸馏 萃取 | D. | 萃取 蒸馏 分液 |
13.设阿伏加德罗常数的值为NA,则下列说法正确的是( )
| A. | 常温常压下,18.0 g NH4+中所含的质子数为10 NA | |
| B. | 室温下,8 g甲烷含有共价键数为2NA | |
| C. | 常温下,2.7 g铝片投入足量的浓硫酸中,铝失去的电子数为0.3NA | |
| D. | 常温下,1 mol/L 的 Na2SO4溶液中含有Na+个数为2NA |
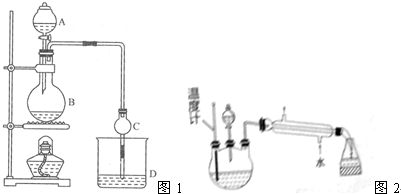
1.某课外小组设计的实验室制取乙酸乙酯的装置如图1所示,A中放有浓硫酸,B中放有乙醇(含18O)、无水醋酸钠,D中放有含有酚酞饱和碳酸钠溶液
已知①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH
②有关有机物的沸点:
请回答:
(1)浓硫酸的作用是制乙酸、催化剂、吸水剂并作催化剂、脱水剂;若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式:CH3COOH+CH3CH218OH$?_{△}^{浓硫酸}$CH3CO18OC2H5+H2O
(2)球形干燥管C的作用是冷凝和防止倒吸、冷凝.反应结束后D中的现象是液体分层,溶液分层,上层无色油体液体,下层溶液颜色变浅
(3)上述实验中饱和碳酸钠溶液的作用是中和乙酸并吸收乙醇,减少乙酸乙酯的溶解
(4)欲从D中得到乙酸乙酯的分离方法是分液;从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入生石灰,并用蒸馏法分离出乙醇,再用法除去乙醚,而得到纯净的乙酸乙酯
(5)某化学课外小组设计了如图2所示的制取乙酸乙酯的装置(图中的铁架台、铁夹,加热装置已略去),与上如图装置相比,此装置的主要优点有(填写处两点)①增加了温度计,便于控制发生装置中反应液的温度,减少副产物的发生,②增加了冷凝装置,有利于收集产物乙酸乙酯
已知①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH
②有关有机物的沸点:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
(1)浓硫酸的作用是制乙酸、催化剂、吸水剂并作催化剂、脱水剂;若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式:CH3COOH+CH3CH218OH$?_{△}^{浓硫酸}$CH3CO18OC2H5+H2O
(2)球形干燥管C的作用是冷凝和防止倒吸、冷凝.反应结束后D中的现象是液体分层,溶液分层,上层无色油体液体,下层溶液颜色变浅
(3)上述实验中饱和碳酸钠溶液的作用是中和乙酸并吸收乙醇,减少乙酸乙酯的溶解
(4)欲从D中得到乙酸乙酯的分离方法是分液;从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入生石灰,并用蒸馏法分离出乙醇,再用法除去乙醚,而得到纯净的乙酸乙酯
(5)某化学课外小组设计了如图2所示的制取乙酸乙酯的装置(图中的铁架台、铁夹,加热装置已略去),与上如图装置相比,此装置的主要优点有(填写处两点)①增加了温度计,便于控制发生装置中反应液的温度,减少副产物的发生,②增加了冷凝装置,有利于收集产物乙酸乙酯

19.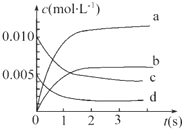 在2L密闭容器内,800℃时反应2NO(g)+O2(g)═2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应2NO(g)+O2(g)═2NO2(g)体系中,n(NO)随时间的变化如表:
(1)上述反应在第5s时,NO的转化率为65%.
(2)如图中表示NO2变化曲线的是b.用O2表示0~2s内该反应的平均速率v=1.5×10-3mol•L-1•s-1.
(3)能说明该反应已达到平衡状态的是bc.
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)铅蓄电池是常用的化学电源,其电极材料是Pb和PbO2,电解液为稀硫酸.工作时该电池总反应式为:PbO2+Pb+2H2SO4═2PbSO4↓+2H2O,据此判断工作时正极反应为PbO2+4H++SO42-+2e-═PbSO4+2H2O.
(5)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水.当它们混合反应时,即产生大量无污染物质并放出大量热.反应的化学方程式为N2H4+2H2O2=N2+4H2O.
 在2L密闭容器内,800℃时反应2NO(g)+O2(g)═2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应2NO(g)+O2(g)═2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)如图中表示NO2变化曲线的是b.用O2表示0~2s内该反应的平均速率v=1.5×10-3mol•L-1•s-1.
(3)能说明该反应已达到平衡状态的是bc.
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)铅蓄电池是常用的化学电源,其电极材料是Pb和PbO2,电解液为稀硫酸.工作时该电池总反应式为:PbO2+Pb+2H2SO4═2PbSO4↓+2H2O,据此判断工作时正极反应为PbO2+4H++SO42-+2e-═PbSO4+2H2O.
(5)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水.当它们混合反应时,即产生大量无污染物质并放出大量热.反应的化学方程式为N2H4+2H2O2=N2+4H2O.
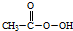 (过氧乙酸)+H2O
(过氧乙酸)+H2O