��Ŀ����
6��ú�����г����о���ͬ�¶���ƽ�ⳣ����Ͷ�ϱȼ����ʵ����⣮��֪CO��g��+H2O��g��?H2��g��+CO2��g����ƽ�ⳣ�����¶ȵı仯���±���
| �¶�/�� | 400 | 500 | 830 | 1 000 |
| ƽ�ⳣ��K | 10 | 9 | 1 | 0.6 |
��1��������Ӧ������Ӧ�Ƿ��ȷ�Ӧ������ȡ������ȡ�����
��2��ij�¶��£�������Ӧ�ﵽƽ���������������������¶ȣ��淴Ӧ�����������������С�����䡱���������ڻ�������ѹǿ������������� С�����䡱����
��3��830��ʱ���ں��ݷ�Ӧ���з���������Ӧ�����±��е����ʵ���Ͷ�뷴Ӧ�����������淴Ӧ������е���AC��ѡ����ĸ��
| A | B | C | D | |
| n��CO2��/mol | 3 | 2.4 | 3.2 | 1 |
| n��H2��/mol | 2 | 1.5 | 2.5 | 1 |
| n��CO��/mol | 1 | 2 | 3.5 | 0.5 |
| n��H2O��/mol | 5 | 2 | 2 | 2 |
���� ��1������ƽ�ⳣ�����¶ȵı仯���ƽ���ƶ�ԭ�������жϷ�Ӧ�������仯�����ݱ������ݿ�֪���¶�����ƽ�ⳣ����С��˵��ƽ�����淴Ӧ�����ƶ���
��2���¶����ߣ���Ӧ��������ƽ�����淴Ӧ�����ƶ���ѹǿ����
��3������830��ʱ��ƽ�ⳣ��k=1������Ũ�ȼ����ƽ�ⳣ���Ƚ��жϣ�
��4��830��ʱ��ƽ�ⳣ��k=1������ƽ������ʽ��ʽ����ƽ��ʱ�����ʵ����ʵ����������������������������
��� �⣺��1�����ݱ������ݿ�֪���¶�����ƽ�ⳣ����С��˵��ƽ�����淴Ӧ�����ƶ���������Ӧ���ȣ��ʴ�Ϊ�����ȣ�
��2���¶����ߣ���Ӧ��������ƽ�����淴Ӧ�����ƶ�����Ӧǰ������������䣬����������ѹǿ֮�ȵ����¶�֮�ȣ�����ѹǿ���ʴ�Ϊ����������
��3������830��ʱ��ƽ�ⳣ��k=1���㣻
A��Q=$\frac{2��3}{5��1}$��1����Ӧ���淴Ӧ�����ƶ�����A��ȷ��
B��Q=$\frac{2.4��1.5}{2��2}$=0.9��1����Ӧ������Ӧ�����ƶ�����B����
C��Q=$\frac{3.2��2.5}{3.5��2}$=1.14��1����Ӧ���淴Ӧ�����ƶ�����C��ȷ��
D��Q=$\frac{1��1}{0.5��2}$=1���ﵽƽ��״̬��ƽ�ⲻ�ƶ�����D����
�ʴ�Ϊ��AC��
��4��830��ʱ����2L���ܱ������м���4molCO��g����6molH2O��g���ﵽƽ��ʱ����һ����̼ת�����ʵ���Ϊx������ƽ������ʽ��ʽ�õ�
CO��g��+H2O��g��?H2��g��+CO2��g��
��ʼ����mol�� 4 6 0 0
�仯����mol�� x x x x
ƽ������mol�� 4-x 6-x x x
ƽ�ⳣ��JK=1���������ʵ������㣬��K=$\frac{{x}^{2}}{��4-x����6-x��}$=1
x=2.4mol
�������������Ϊ$\frac{2.4}{4+6}$��100%=24%
�ʴ�Ϊ��24%��
���� �����ۺϿ��黯ѧƽ��ļ��㣬Ϊ��Ƶ���㣬������ѧ���ķ��������������Ŀ��飬����ע����ջ�ѧƽ�ⳣ����������Ӧ�ã��ѶȲ���

| A�� | ���³�ѹ�£�48g O2�к���ԭ����Ϊ3NA | |
| B�� | ��״���£�22.4 L H2O������ԭ����Ϊ3NA | |
| C�� | 1 mol/L��K2SO4��Һ�У���2 NA��K+ | |
| D�� | 24g Mg��ΪMg2+ʱʧȥ�ĵ�����ΪNA |
| A�� | A��B����Է�������֮��Ϊa��b | |
| B�� | ͬ��ͬѹ�£�A��B��ԭ����֮��Ϊb��a | |
| C�� | ͬ������A��B�����ʵ���֮��Ϊb��a | |
| D�� | ͬ��ͬѹ�£�ͬ�����A��B������֮��Ϊa��b |
 �״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ������ҵ��һ��������з�Ӧ�ϳɼ״�CO��g��+2H2��g��?CH3OH��g����H
�״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ������ҵ��һ��������з�Ӧ�ϳɼ״�CO��g��+2H2��g��?CH3OH��g����H��1���±����������Ƿ�Ӧ�ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ����K����
| �¶� | 250�� | 300�� | 350�� |
| K | 3.041 | 1.000 | 0.120 |
��2��300��ʱ�������Ϊ2.0L���ܱ�������ͨ��2mol CO��4mol H2������20s �ﵽƽ��״̬��
�ټ���20s��CO�ķ�Ӧ����Ϊ0.025mol/��L•s������ʱ�����м״����������Ϊ25%��
����������ƽ����ϵ��ͬʱ����1mol CO��2mol H2��1mol CH3OH���壬ƽ���ƶ����������
������ҡ����������ƶ�������ԭ������������ƽ����ϵ��ͬʱ����1molCO��2molH2��1molCH3OH���壬��ʱŨ��c��CO��=0.5mol/L+$\frac{1}{2}$mol/L=1mol/L��n��H2��=2��1-0.5��mol/L+$\frac{2mol}{2L}$=2mol/L��c��CH3OH��=0.5mol/L+$\frac{1mol}{2L}$=1mol/L����ʱŨ���Ϻ�Qc=$\frac{1}{1��{2}^{2}}$=0.25��K=1��ƽ�������ƶ���
��3����֪�ڳ��³�ѹ�£�
��2CH3OH��l��+3O2��g��=2CO2��g��+4H2O��g����H1=-1277.0kJ/mol
��2CO��g��+O2��g��=2CO2��g����H2=-566.0kJ/mol
��H2O��g��=H2O��l����H3=-44kJ/molд���״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽ��CH3OH��l��+O2��g��=CO��g��+2H2O��l����H=-443.5KJ/mol��
��4���״�������������ȼ�ϵ�أ�д������������Ϊ����ʼ״�ȼ�ϵ�ظ�����ӦʽCH3OH+8OH--6e-=CO32-+6H2O����ͼ�����KI��Һ�Ƶ⣬�ڴ��Թ��м��뱥�͵�KI��Һ��Ȼ���ټ��뱽������һ��ʯī�缫��һ�����缫��ʹ�ø�ȼ�ϵ������Դ�����缫�븺���������������ӣ�ͨ��һ��ʱ��Ͽ���Դ�����Թܣ��ϲ���ҺΪ�Ϻ�ɫ������1.27g �ⵥ������ʱ����Ҫ0.053g CH3OH��
| A�� | ���֮��11��8 | B�� | �ܶ�֮�� 11��8 | ||
| C�� | ���ʵ���֮��8��11 | D�� | ԭ����֮��8��11 |
| A�� | ���ö����ЧӦ�������ֵ����ܽ��ͷ���ˮ | |
| B�� | 1L1 mol•L-1Fe��OH��3�����У�������ĿС��NA | |
| C�� | PM2.5��ָ������ֱ���ӽ���2.5��10-6m��1m=109nm���Ŀ����Ҳ�ƿ�����������Щϸ�������ɢ�ڿ������γɵķ�ɢϵ�ǽ��� | |
| D�� | Fe��OH��3����ĵ�Ӿʵ��˵���˽�����е�� |
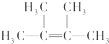 ��������2��3-����-2-��ϩ��
��������2��3-����-2-��ϩ��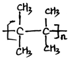 ��
�� ����CH3CH2��2C=CH2������˳���칹����
����CH3CH2��2C=CH2������˳���칹����