题目内容
11.同温同压下,质量相等的O2和CO2 相比较,下列叙述正确的是( )| A. | 体积之比11:8 | B. | 密度之比 11:8 | ||
| C. | 物质的量之比8:11 | D. | 原子数之比8:11 |
分析 先设出二者的质量,再利用n=$\frac{m}{M}$来计算O2和CO2的物质的量,根据阿伏加德罗定律的推论:同温同压下,气体的体积之比等于物质的量之比;同温同压下,气体密度之比等于摩尔质量的之比;同温同压下,分子数之比等于物质的量之比.
解答 解:设二者的质量都是mg,则O2和CO2的物质的量分别为$\frac{m}{32}$mol、$\frac{m}{44}$mol,
A.同温同压下,体积之比等于物质的量之比=$\frac{m}{32}$mol:$\frac{m}{44}$mol=11:8,故A正确;
B.同温同压下,气体密度之比等于摩尔质量的之比,即为32:44=8:11,故B错误;
C.二者的质量都是mg,则O2和CO2的物质的量分别为$\frac{m}{32}$mol、$\frac{m}{44}$mol,物质的量之比为$\frac{m}{32}$mol:$\frac{m}{44}$mol=11:8,故C错误;
D.同温同压下,分子数之比等于物质的量之比,即分子数之比是11:8,所以原子数之比是(11×2):(8×3)=22:24=11:12,故D错误;
故选A.
点评 本题考查物质的量的计算,明确同温同压下,物质的量之比等于体积比等于分子数之比是解答的关键,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
16.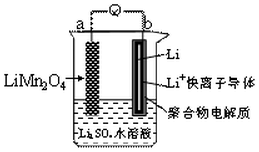 新能源汽车如(比亚迪秦、唐)相对传统汽车.有一系列的优点.如:环保、加速快(比亚迪唐0-100km/h加速时间仅需4.9秒).而新能源汽车一个核心部件为锂离子电池,如图是我国科学家报道的某种水溶液锂离子电池体系.下列叙述错误的是( )
新能源汽车如(比亚迪秦、唐)相对传统汽车.有一系列的优点.如:环保、加速快(比亚迪唐0-100km/h加速时间仅需4.9秒).而新能源汽车一个核心部件为锂离子电池,如图是我国科学家报道的某种水溶液锂离子电池体系.下列叙述错误的是( )
 新能源汽车如(比亚迪秦、唐)相对传统汽车.有一系列的优点.如:环保、加速快(比亚迪唐0-100km/h加速时间仅需4.9秒).而新能源汽车一个核心部件为锂离子电池,如图是我国科学家报道的某种水溶液锂离子电池体系.下列叙述错误的是( )
新能源汽车如(比亚迪秦、唐)相对传统汽车.有一系列的优点.如:环保、加速快(比亚迪唐0-100km/h加速时间仅需4.9秒).而新能源汽车一个核心部件为锂离子电池,如图是我国科学家报道的某种水溶液锂离子电池体系.下列叙述错误的是( )| A. | a为电池的正极 | |
| B. | 电池充电反应为LiMn2O4═Li1-xMn2O4+xLi | |
| C. | 放电时,a极锂的化合价发生变化 | |
| D. | 放电时,溶液中Li+从b向a迁移 |
13.下列离子方程式正确的是( )
| A. | 用醋酸除水垢:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 用小苏打治疗胃酸过多:CO32-+2H+═CO2↑+H2O | |
| C. | 碳酸氢钠溶液与少量石灰水反应:2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O | |
| D. | 向澄清石灰水中通入过量二氧化碳:Ca2++2OH-+CO2═CaCO3↓+H2O |
6.煤化工中常需研究不同温度下平衡常数、投料比及产率等问题.
已知CO(g)+H2O(g)?H2(g)+CO2(g)的平衡常数随温度的变化如下表:
试回答下列问题:
(1)上述反应的正反应是放热反应(填“放热”或“吸热”).
(2)某温度下,上述反应达到平衡后,保持容器体积不变升高温度,逆反应速率增大(填“增大”、“减小”或“不变”),容器内混合气体的压强增大(填“增大”、“减 小”或“不变”).
(3)830℃时,在恒容反应器中发生上述反应,按下表中的物质的量投入反应混合物,其中向逆反应方向进行的有AC(选填字母)
(4)在830℃时,在2L的密闭容器中加入4mol CO(g)和6mol H2O(g)达到平衡时,H2(g)的体积分数是24%.
已知CO(g)+H2O(g)?H2(g)+CO2(g)的平衡常数随温度的变化如下表:
| 温度/℃ | 400 | 500 | 830 | 1 000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
(1)上述反应的正反应是放热反应(填“放热”或“吸热”).
(2)某温度下,上述反应达到平衡后,保持容器体积不变升高温度,逆反应速率增大(填“增大”、“减小”或“不变”),容器内混合气体的压强增大(填“增大”、“减 小”或“不变”).
(3)830℃时,在恒容反应器中发生上述反应,按下表中的物质的量投入反应混合物,其中向逆反应方向进行的有AC(选填字母)
| A | B | C | D | |
| n(CO2)/mol | 3 | 2.4 | 3.2 | 1 |
| n(H2)/mol | 2 | 1.5 | 2.5 | 1 |
| n(CO)/mol | 1 | 2 | 3.5 | 0.5 |
| n(H2O)/mol | 5 | 2 | 2 | 2 |
16.下列有关实验操作的说法正确的是( )
| A. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| B. | 检验氨气时,需用玻璃棒沾取湿润的红色石蕊试纸靠近导管口 | |
| C. | 用稀硝酸溶液洗涤并灼烧铂丝后,再进行焰色反应 | |
| D. | 用CCl4萃取溴水中的溴,分液时有机层从分液漏斗的上口倒出 |
1.已知反应X+Y=M+N为放热反应,对该反应的下列说法中正确的是( )
| A. | X的能量一定高于M,Y的能量一定高于N | |
| B. | 因该反应为放热反应,故不必加热就可以发生 | |
| C. | X和Y的总能量一定高于M和N的总能量 | |
| D. | 破坏反应物中的化学键所吸收的能量大于形成生成物中的化学键所放出的能量 |
