题目内容
8.在标准状况下,ag气体A与bg气体B的分子数相等,則下列说法中不正确的是( )| A. | A和B的相对分子质最之比为a:b | |
| B. | 同温同压下,A和B的原子数之比为b:a | |
| C. | 同质量的A和B的物质的量之比为b:a | |
| D. | 同温同压下,同体积的A和B的质量之比为a:b |
分析 标准状况下,分子数相同的气体A和B,它们的物质的量相同,则相对分子质量之比、同体积的气体的体积之比均等于质量之比、分子数之比与物质的摩尔质量成反比,由此分析解答.
解答 解:A、由n=$\frac{m}{M}$可知,分子数相同的气体,物质的量相同,摩尔质量之比等于质量之比,即A与B摩尔质量之比为ag:bg=a:b,所以两种气体A与B的相对分子质量之比为a:b,故A正确;
B、分子的组成不知,所以无法确定,故B错误;
C、A与B相对分子质量之比为a:b,同质量时由n=$\frac{m}{M}$可知,物质的量之比等于$\frac{1}{a}$:$\frac{1}{b}$=b:a,故C正确;
D、相同状况下,同体积的A与B的物质的量相同,则质量之比等于摩尔质量之比,即为a:b,故D正确;
故选B.
点评 本题考查阿伏伽德罗定律及其推论,明确同温、同压、同体积,则气体的分子数相同、物质的量相同及质量、物质的量、摩尔质量的关系是解答的关键.

练习册系列答案
相关题目
16.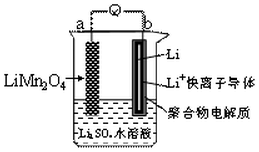 新能源汽车如(比亚迪秦、唐)相对传统汽车.有一系列的优点.如:环保、加速快(比亚迪唐0-100km/h加速时间仅需4.9秒).而新能源汽车一个核心部件为锂离子电池,如图是我国科学家报道的某种水溶液锂离子电池体系.下列叙述错误的是( )
新能源汽车如(比亚迪秦、唐)相对传统汽车.有一系列的优点.如:环保、加速快(比亚迪唐0-100km/h加速时间仅需4.9秒).而新能源汽车一个核心部件为锂离子电池,如图是我国科学家报道的某种水溶液锂离子电池体系.下列叙述错误的是( )
 新能源汽车如(比亚迪秦、唐)相对传统汽车.有一系列的优点.如:环保、加速快(比亚迪唐0-100km/h加速时间仅需4.9秒).而新能源汽车一个核心部件为锂离子电池,如图是我国科学家报道的某种水溶液锂离子电池体系.下列叙述错误的是( )
新能源汽车如(比亚迪秦、唐)相对传统汽车.有一系列的优点.如:环保、加速快(比亚迪唐0-100km/h加速时间仅需4.9秒).而新能源汽车一个核心部件为锂离子电池,如图是我国科学家报道的某种水溶液锂离子电池体系.下列叙述错误的是( )| A. | a为电池的正极 | |
| B. | 电池充电反应为LiMn2O4═Li1-xMn2O4+xLi | |
| C. | 放电时,a极锂的化合价发生变化 | |
| D. | 放电时,溶液中Li+从b向a迁移 |
3.在溶液中能大量共存的离子组是( )
| A. | Ca2+ CO32- Cl- | B. | H+ SO42- Ba2+ | ||
| C. | K+ H+OH- | D. | Fe3+ Na+ NO3- |
13.下列离子方程式正确的是( )
| A. | 用醋酸除水垢:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 用小苏打治疗胃酸过多:CO32-+2H+═CO2↑+H2O | |
| C. | 碳酸氢钠溶液与少量石灰水反应:2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O | |
| D. | 向澄清石灰水中通入过量二氧化碳:Ca2++2OH-+CO2═CaCO3↓+H2O |
6.煤化工中常需研究不同温度下平衡常数、投料比及产率等问题.
已知CO(g)+H2O(g)?H2(g)+CO2(g)的平衡常数随温度的变化如下表:
试回答下列问题:
(1)上述反应的正反应是放热反应(填“放热”或“吸热”).
(2)某温度下,上述反应达到平衡后,保持容器体积不变升高温度,逆反应速率增大(填“增大”、“减小”或“不变”),容器内混合气体的压强增大(填“增大”、“减 小”或“不变”).
(3)830℃时,在恒容反应器中发生上述反应,按下表中的物质的量投入反应混合物,其中向逆反应方向进行的有AC(选填字母)
(4)在830℃时,在2L的密闭容器中加入4mol CO(g)和6mol H2O(g)达到平衡时,H2(g)的体积分数是24%.
已知CO(g)+H2O(g)?H2(g)+CO2(g)的平衡常数随温度的变化如下表:
| 温度/℃ | 400 | 500 | 830 | 1 000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
(1)上述反应的正反应是放热反应(填“放热”或“吸热”).
(2)某温度下,上述反应达到平衡后,保持容器体积不变升高温度,逆反应速率增大(填“增大”、“减小”或“不变”),容器内混合气体的压强增大(填“增大”、“减 小”或“不变”).
(3)830℃时,在恒容反应器中发生上述反应,按下表中的物质的量投入反应混合物,其中向逆反应方向进行的有AC(选填字母)
| A | B | C | D | |
| n(CO2)/mol | 3 | 2.4 | 3.2 | 1 |
| n(H2)/mol | 2 | 1.5 | 2.5 | 1 |
| n(CO)/mol | 1 | 2 | 3.5 | 0.5 |
| n(H2O)/mol | 5 | 2 | 2 | 2 |