题目内容
16.0.6mol O2与0.4mol O3质量之比为1:1,分子个数之比为3:2,原子个数之比1:1,它们在同温同压下的体积比是3:2.分析 根据m=nM计算出二者的质量之比;分子个数与物质的量成正比;原子个数与原子的物质的量成正比;同温同压下气体体积之比等于物质的量之比.
解答 解:m(O2):m(O3)=0.6mol×32g/mol:0.4mol×48g/mol=1:1,N(O2):N(O3)=0.6NA:0.4NA=3:2,原子个数之比0.6×2NA:0.4×3NA=1:1,
它们在同温同压下的体积比是V(O2):V(O3)=0.6mol×22.4L/mol:0.4mol×22.4L/mol=3:2,
故答案为:1:1;3:2;1:1;3:2.
点评 本题考查物质的量的相关计算,侧重于学生的分析能力和计算能力的考查,为高频考点,注意把握相关计算公式的运用,难度不大.

练习册系列答案
相关题目
6.煤化工中常需研究不同温度下平衡常数、投料比及产率等问题.
已知CO(g)+H2O(g)?H2(g)+CO2(g)的平衡常数随温度的变化如下表:
试回答下列问题:
(1)上述反应的正反应是放热反应(填“放热”或“吸热”).
(2)某温度下,上述反应达到平衡后,保持容器体积不变升高温度,逆反应速率增大(填“增大”、“减小”或“不变”),容器内混合气体的压强增大(填“增大”、“减 小”或“不变”).
(3)830℃时,在恒容反应器中发生上述反应,按下表中的物质的量投入反应混合物,其中向逆反应方向进行的有AC(选填字母)
(4)在830℃时,在2L的密闭容器中加入4mol CO(g)和6mol H2O(g)达到平衡时,H2(g)的体积分数是24%.
已知CO(g)+H2O(g)?H2(g)+CO2(g)的平衡常数随温度的变化如下表:
| 温度/℃ | 400 | 500 | 830 | 1 000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
(1)上述反应的正反应是放热反应(填“放热”或“吸热”).
(2)某温度下,上述反应达到平衡后,保持容器体积不变升高温度,逆反应速率增大(填“增大”、“减小”或“不变”),容器内混合气体的压强增大(填“增大”、“减 小”或“不变”).
(3)830℃时,在恒容反应器中发生上述反应,按下表中的物质的量投入反应混合物,其中向逆反应方向进行的有AC(选填字母)
| A | B | C | D | |
| n(CO2)/mol | 3 | 2.4 | 3.2 | 1 |
| n(H2)/mol | 2 | 1.5 | 2.5 | 1 |
| n(CO)/mol | 1 | 2 | 3.5 | 0.5 |
| n(H2O)/mol | 5 | 2 | 2 | 2 |
7.某有机物结构简式如图所示,有关它的说法正确的是( )


| A. | 它属于芳香烃 | B. | 分子中所有的碳原子共面 | ||
| C. | 分子式为C14H8Cl5 | D. | 1 mol该物质能与6 molH2加成 |
11.已知500℃时,反应H2(g)+I2(g)?2HI(g)的K=100,由此推测在500℃时,反应HI(g)?$\frac{1}{2}$H2(g)+$\frac{1}{2}$I2(g)的化学平衡常数为( )
| A. | 0.01 | B. | 100 | C. | 0.1 | D. | 无法确定 |
1.已知反应X+Y=M+N为放热反应,对该反应的下列说法中正确的是( )
| A. | X的能量一定高于M,Y的能量一定高于N | |
| B. | 因该反应为放热反应,故不必加热就可以发生 | |
| C. | X和Y的总能量一定高于M和N的总能量 | |
| D. | 破坏反应物中的化学键所吸收的能量大于形成生成物中的化学键所放出的能量 |
8.能正确表示下列反应的离子方程式是( )
| A. | 硫酸铝溶液中加入过量氨水 Al3++3OH-═Al(OH)3↓ | |
| B. | 碳酸钠溶液中加入澄清石灰水 Ca(OH)2+CO32-═CaCO3↓+2OH- | |
| C. | 向NaHCO3溶液中加入少量的澄清石灰水,出现白色沉淀2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O | |
| D. | 稀硫酸中加入铁粉 2Fe+6H+═2Fe3++3H2↑ |
5.已知常温下,几种氢氧化物开始沉淀和完全沉淀的pH如表所示:
某矿渣所含各物质的质量分数如表所示:
已知常温下,几种氢氧化物开始沉淀和完全沉淀的pH如表所示:
某课题组拟以上述矿渣为原料制备金属镁、铝、铜、铁,其部分工艺流程如图:
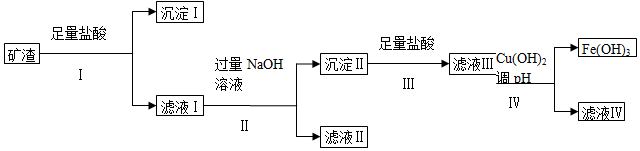
请回答下列问题:
(1)沉淀Ⅰ的主要用途是制光导纤维(列一种即可),步骤Ⅳ中调节pH范围为大于3.7小于4.8.
(2)由滤液Ⅱ经几步反应可得到需要制备的一种金属的氧化物,滤液Ⅱ中需要通入气体的化学式CO2,反应的化学方程式为NaAlO2+CO2+H2O═NaHCO3+Al(OH)3↓,2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O.
(3)写出由滤液Ⅰ得到滤液Ⅱ的离子方程式Al3++4OH-═AlO2-+2H2O.
(4)滤液Ⅳ中含有的金属阳离子是Mg2+、Cu2+.
(5)工业上,冶炼铝、铁、铜、镁的方法依次是B(填代号).
A.电解法、热还原法、分解法、分解法 B.电解法、热还原法、热还原法、电解法
C.热还原法、分解法、电解法、电解法 D.热还原法、热还原法、热还原法、电解法
在工业生产中,冶炼这些金属时选择的相应物质的化学式依次是Al2O3、Fe2O3、CuO、MgCl2.
某矿渣所含各物质的质量分数如表所示:
| 成分 | SiO2 | MgO | Fe2O3 | Al2O3 | CuO |
| 质量分数(%) | ? | 4.0 | 32 | 10.2 | 16 |
| Cu(OH)2 | Mg(OH)2 | Fe(OH)3 | Al(OH)3 | |
| 开始沉淀的pH | 4.8 | 9.3 | 2.7 | 3.8 |
| 完全沉淀的pH | 6.4 | 10.8 | 3.7 | 4.7 |

请回答下列问题:
(1)沉淀Ⅰ的主要用途是制光导纤维(列一种即可),步骤Ⅳ中调节pH范围为大于3.7小于4.8.
(2)由滤液Ⅱ经几步反应可得到需要制备的一种金属的氧化物,滤液Ⅱ中需要通入气体的化学式CO2,反应的化学方程式为NaAlO2+CO2+H2O═NaHCO3+Al(OH)3↓,2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O.
(3)写出由滤液Ⅰ得到滤液Ⅱ的离子方程式Al3++4OH-═AlO2-+2H2O.
(4)滤液Ⅳ中含有的金属阳离子是Mg2+、Cu2+.
(5)工业上,冶炼铝、铁、铜、镁的方法依次是B(填代号).
A.电解法、热还原法、分解法、分解法 B.电解法、热还原法、热还原法、电解法
C.热还原法、分解法、电解法、电解法 D.热还原法、热还原法、热还原法、电解法
在工业生产中,冶炼这些金属时选择的相应物质的化学式依次是Al2O3、Fe2O3、CuO、MgCl2.
3. 甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应I和II来制备甲醇.请回答下列问题:
甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应I和II来制备甲醇.请回答下列问题:
(1)将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为l00L),在一定条件下发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g)
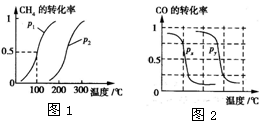
I.CH4的转化率与温度、压强的关系如图1所示.
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为0.003mol/(L•min).
②图中的P1<P2(填“<”、“>”或“=”),100℃时平衡常数为2.25×10-4.
③该反应的△H>0 (填“<”、“>”或“=”).
(2)在压强为0.1MPa条件下,a mol CO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)?CH3OH(g);△H<0Ⅱ.
①若容器容积不变,下列措施可增加甲醇产率的是BD(填序号).
A.升高温度
B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大
D.再充人lmolCO和3mol H2
②为了寻找合成甲醇的适宜温度和压强,某同学设计了三组实验,部分实验条件已经填在了如表的实验设计表中.如表中剩余的实验条件数据:
n=150,m=$\frac{1}{3}$.
b.根据反应Ⅱ的特点,如图2是在压强分别为0.1 MPa和5 MPa下CO的转化率随温度变化的曲线图,请指明图中的压强Px=0.1MPa.
 甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应I和II来制备甲醇.请回答下列问题:
甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应I和II来制备甲醇.请回答下列问题:(1)将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为l00L),在一定条件下发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g)
I.CH4的转化率与温度、压强的关系如图1所示.
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为0.003mol/(L•min).
②图中的P1<P2(填“<”、“>”或“=”),100℃时平衡常数为2.25×10-4.
③该反应的△H>0 (填“<”、“>”或“=”).
(2)在压强为0.1MPa条件下,a mol CO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)?CH3OH(g);△H<0Ⅱ.
①若容器容积不变,下列措施可增加甲醇产率的是BD(填序号).
A.升高温度
B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大
D.再充人lmolCO和3mol H2
②为了寻找合成甲醇的适宜温度和压强,某同学设计了三组实验,部分实验条件已经填在了如表的实验设计表中.如表中剩余的实验条件数据:
| 实验编号 | T(℃) | n(CO)/n(H2) | p(MPa) |
| l | 150 | $\frac{1}{3}$ | 0.1 |
| 2 | n | $\frac{1}{3}$ | 5 |
| 3 | 350 | m | 5 |
b.根据反应Ⅱ的特点,如图2是在压强分别为0.1 MPa和5 MPa下CO的转化率随温度变化的曲线图,请指明图中的压强Px=0.1MPa.