题目内容
11.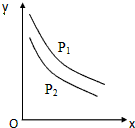 反应:L(固)+aG(气)=bR(气)达到平衡时,温度和压强对该反应的影响如图所示:图中:压强p1>p2,X轴表示温度,Y轴表示平衡混合气中G的体积分数.据此可判断( )
反应:L(固)+aG(气)=bR(气)达到平衡时,温度和压强对该反应的影响如图所示:图中:压强p1>p2,X轴表示温度,Y轴表示平衡混合气中G的体积分数.据此可判断( )| A. | 上述反应是放热反应 | B. | 增加L平衡右移 | ||
| C. | a>b | D. | a<b |
分析 根据图知,压强不变时,升高温度,G的体积分数减小,说明平衡正向移动;温度一定时,增大压强,G的体积分数增大,平衡逆向移动,据此分析解答.
解答 解:根据图知,压强不变时,升高温度,G的体积分数减小,说明平衡正向移动,升高温度平衡向吸热方向移动,所以正反应是吸热反应;
温度一定时,增大压强,G的体积分数增大,平衡逆向移动,增大压强平衡向气体体积减小的方向移动,所以a<b;
固体质量的多少不影响平衡移动,
故选D.
点评 本题考查化学平衡移动影响因素,为高频考点,侧重考查学生识图能力及知识综合应用能力,明确温度、压强对化学平衡移动影响原理是解本题关键,易错选项是B.

练习册系列答案
 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目
1.下列物质属于酸的是( )
| A. | 二氧化硫 | B. | 生石灰 | C. | 三氧化硫 | D. | 硫酸 |
2.等物质的量浓度的下列溶液混合后,所得溶液呈中性的是( )
| A. | 20mLNH3•H2O与20mLH2SO4 | B. | 10mLCa(HCO3)2与10mLNaOH | ||
| C. | 20mLNaHCO3与10mLCa(OH)2 | D. | 20mLNaHSO4与10mLBa(OH)2 |
6.常温下有以下体积相同的四种溶液:①pH=3的CH3COOH溶液 ②pH=3的盐酸 ③pH=11的氨水 ④pH=4的NaOH溶液,下列说法正确的是( )
| A. | ①与②分别与足量镁粉反应,生成H2的量:①<② | |
| B. | ②和③混合,所得混合溶液的pH大于7 | |
| C. | ③和④分别用等浓度的硫酸溶液中和,消耗硫酸溶液的体积:③=④ | |
| D. | 若将四种溶液稀释100倍,溶液pH大小顺序:③>④>①>② |
16. 某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验).
某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验).
实验记录如下:
请回答下列问题:
(1)A中反应的离子方程式是2Br-+Cl2=Br2+2Cl-.
(2)实验操作Ⅱ吹入热空气的目的是吹出单质Br2.
(3)实验操作Ⅲ,混合液逐渐变成红棕色,其对应的离子方程式H2O2+2Br-+2H+=Br2+2H2O.
(4)由上述实验得出的结论是氧化性:H2O2>Br2>H2SO3.
 某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验).
某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验).实验记录如下:
| 实验操作 | 实验现象 | |
| I | 打开活塞a,滴加氯水,关闭活塞a | A中溶液变为红棕色. |
| II | 吹入热空气 | A中红棕色明显变浅;B中有气泡,产生大量白色沉淀,混合液颜色无明显变化. |
| III | 停止吹入空气,打开活塞b,逐滴加入H2O2溶液 | 开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色. |
(1)A中反应的离子方程式是2Br-+Cl2=Br2+2Cl-.
(2)实验操作Ⅱ吹入热空气的目的是吹出单质Br2.
(3)实验操作Ⅲ,混合液逐渐变成红棕色,其对应的离子方程式H2O2+2Br-+2H+=Br2+2H2O.
(4)由上述实验得出的结论是氧化性:H2O2>Br2>H2SO3.
3.下列关于铅蓄电池的说法正确的是( )
| A. | 放电时,电池的负极质量减轻 | |
| B. | 放电时,正极周围的pH升高 | |
| C. | 充电时,电池中硫酸的浓度不断减小 | |
| D. | 充电时,阳极发生的反应是PbSO4(s)+2e-═Pb(s)+SO42-(aq) |
17.下列检测方法不合理的是( )
| 实验 | 检验方法 | |
| A | 向沸水中滴加饱和FeCl3溶液,制备胶体 | 用可见光束照射 |
| B | 确认铜与浓硫酸反应生成CuSO4 | 将反应后溶液转入盛有水的烧杯中 |
| C | 区分AgNO3溶液和Al2(SO4)3溶液 | 分别取少量溶液,滴加BaCl2溶液 |
| D | 证明氯水中起漂白作用的不是Cl2 | 用CCl4充分萃取,将红纸条分别浸入分层后的溶液中 |
| A. | A | B. | B | C. | C | D. | D |
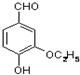 是食品添加剂的增香原料,其香味比香草醛更浓郁.
是食品添加剂的增香原料,其香味比香草醛更浓郁.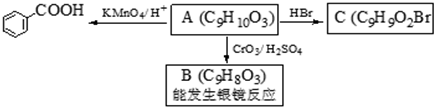
 .
. .
.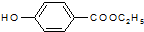 )是一种医药中间体,请设计合理方案用对甲基苯酚合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).
)是一种医药中间体,请设计合理方案用对甲基苯酚合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).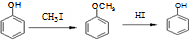
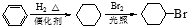
 .
.