题目内容
 用活性炭还原法处理氮氧化物.有关反应为:C(s)+2NO(g)?N2 (g)+CO2 (g).某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
用活性炭还原法处理氮氧化物.有关反应为:C(s)+2NO(g)?N2 (g)+CO2 (g).某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:浓度/mol?L-1 时间/min | NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 10 | 0.58 | 0.21 | 0.21 |
| 20 | 0.40 | 0.30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 40 | 0.32 | 0.34 | 0.17 |
| 50 | 0.32 | 0.34 | 0.17 |
②该反应的平衡常数K表达式为
③下列各项能作为判断该反应达到平衡的是
A.容器内压强保持不变
B. 2V正 (NO)=V逆 (N2)
C.容器内CO2的体积分数不变
D.混合气体的密度保持不变
④30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是
⑤一定温度下,随着NO的起始浓度增大,则NO的平衡转化率
考点:化学平衡状态的判断,化学平衡的影响因素
专题:
分析:①由图表数据分析,结合反应速率概念计算得到,v=
;
②依据平衡常数的概念来书写表达式;
③依据化学平衡状态的实质是正逆反应速率相等,结合反应特征分析判断;
④依据图表数据变化分析,30min末一氧化氮和二氧化碳浓度减小,氮气浓度增大,结合计算平衡常数和浓度变化分析判断;改变的条件可能是减小二氧化碳浓度,据此画出图象;
⑤反应是气体体积不变的反应,反应物只有气体一氧化氮,增大一氧化氮浓度相当于增大容器内压强对平衡的影响分析.
| △c |
| △t |
②依据平衡常数的概念来书写表达式;
③依据化学平衡状态的实质是正逆反应速率相等,结合反应特征分析判断;
④依据图表数据变化分析,30min末一氧化氮和二氧化碳浓度减小,氮气浓度增大,结合计算平衡常数和浓度变化分析判断;改变的条件可能是减小二氧化碳浓度,据此画出图象;
⑤反应是气体体积不变的反应,反应物只有气体一氧化氮,增大一氧化氮浓度相当于增大容器内压强对平衡的影响分析.
解答:
解:①10min~20min以v(CO2) 表示的反应速率=
=0.009 mol?L-1?min-1,故答案为:0.009 mol?L-1?min-1;
②反应的平衡常数为:K=
,故答案为:
;
③C(s)+2NO(g)?N2(g)+CO2(g),反应是气体体积不变的反应;
A.反应是气体体积不变的反应,反应过程中和反应平衡状态压强相同,所以容器内压强保持不变不能说明反应达到平衡,故A错误;
B.反应速率之比等于化学方程式系数之比,当v正(NO)=2v逆(N2),反应达到平衡,v正(NO)=2v正(N2)z只能说明反应正向进行,故B错误;
C.容器内CO2的体积分数不变,说明反应达到平衡,故C正确;
D.混合气体密度等于质量除以体积,反应中碳是固体,平衡移动气体质量变化,体积不变,所以混合气体的密度保持不变,说明反应达到平衡,故D正确;
故选CD;
④30min时改变某一条件,反应重新达到平衡,依据平衡常数计算得到c(N2)=0.34mol/L;c(CO2)=0.17mol/L;c(NO)=0.32mol/L;K=
=
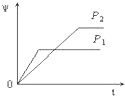
=0.56,化学平衡常数随温度变化,平衡常数不变说明改变的条件一定不是温度;依据数据分析,氮气浓度增大,二氧化碳和一氧化氮浓度减小,反应前后气体体积不变,所以减小二氧化碳浓度,平衡正向进行的结果;依据二氧化碳浓度减小在图象中画出浓度变化如图所示,作图要点:①起点在30min时V逆(CO2)的一半左右;②终点不超过30min时V逆(CO2),则图象为 ,
,
故答案为:减小CO2 的浓度; ;
;
⑤一定温度下,随着NO的起始浓度增大,C(s)+2NO(g)?N2(g)+CO2(g).反应是气体体积不变的反应;增大一氧化氮浓度相当于增大体系压强,平衡不动,一氧化氮转化率不变,故答案为:不变.
| 0.3mol/L-0.21mol/L |
| 10min |
②反应的平衡常数为:K=
| c(CO2)c(N2) |
| c2(NO) |
| c(CO2)c(N2) |
| c2(NO) |
③C(s)+2NO(g)?N2(g)+CO2(g),反应是气体体积不变的反应;
A.反应是气体体积不变的反应,反应过程中和反应平衡状态压强相同,所以容器内压强保持不变不能说明反应达到平衡,故A错误;
B.反应速率之比等于化学方程式系数之比,当v正(NO)=2v逆(N2),反应达到平衡,v正(NO)=2v正(N2)z只能说明反应正向进行,故B错误;
C.容器内CO2的体积分数不变,说明反应达到平衡,故C正确;
D.混合气体密度等于质量除以体积,反应中碳是固体,平衡移动气体质量变化,体积不变,所以混合气体的密度保持不变,说明反应达到平衡,故D正确;
故选CD;
④30min时改变某一条件,反应重新达到平衡,依据平衡常数计算得到c(N2)=0.34mol/L;c(CO2)=0.17mol/L;c(NO)=0.32mol/L;K=
| c(CO2)c(N2) |
| c2(NO) |
| 0.34×0.17 |
| 0.322 |
 ,
,故答案为:减小CO2 的浓度;
 ;
;⑤一定温度下,随着NO的起始浓度增大,C(s)+2NO(g)?N2(g)+CO2(g).反应是气体体积不变的反应;增大一氧化氮浓度相当于增大体系压强,平衡不动,一氧化氮转化率不变,故答案为:不变.
点评:本题考查化学反应速率、化学平衡常数及其化学平衡影响因素和平衡标志的分析判断,图象绘制是解题的难点,题目难度中等.

练习册系列答案
相关题目
一些治感冒的药物含有PPA(醇胺)成分,PPA对感冒有比较好的对症疗效,但也有较大的副作用,我国早已禁止使用含有PPA成分的感冒药.从其名称看,其有机成分的分子结构中不含下列中的( )
| A、-OH |
| B、-COOH |
| C、-C6H5 |
| D、-NH2 |
向水中分别加入下列溶液,对水的电离平衡不产生影响的是( )
| A、KHSO4溶液 |
| B、KHCO3溶液 |
| C、KHS溶液 |
| D、KI溶液 |
已知25℃下,0.1mol/L某二元酸(H2A)溶液的pH大于1,其酸式盐NaHA溶液的pH<7.取等体积的H2A溶液和NaOH溶液混合后,所得溶液的pH=7,则酸溶液与碱溶液的物质的量浓度之比是( )
| A、小于0.5 |
| B、等于0.5 |
| C、大于1且小于2 |
| D、大于0.5且小于1 |
在反应3S+6NaOH=2Na2S+Na2SO3+3H2O中,氧化剂和还原剂物质的量之比为( )
| A、1:2 | B、1:3 |
| C、2:1 | D、3:1 |
今有如下三个热化学方程式:下列关于它们的叙述正确的是( )
(1)H2(g)+
O2(g)═H2O(g)△H1=a kJ?mol-1;
(2)H2(g)+
O2(g)═H2O(l)△H2=b kJ?mol-1;
(3)2H2(g)+O2(g)═H2O(l)△H3=c kJ?mol-1.
(1)H2(g)+
| 1 |
| 2 |
(2)H2(g)+
| 1 |
| 2 |
(3)2H2(g)+O2(g)═H2O(l)△H3=c kJ?mol-1.
| A、它们都是吸热反应 |
| B、a,b和c均为负值 |
| C、a=b |
| D、2b=c>0 |
某粒子用符号AZMn+表示,下列关于该粒子的叙述正确的是( )
| A、所含质子数为(A-n) |
| B、所含中子数为(A-Z) |
| C、所含电子数为(Z+n) |
| D、该粒子比M原子多n个电子 |