题目内容
NiSO4?6H2O是绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含Cu、Zn、Fe、Cr等杂质)为原料获得.操作步骤如下:
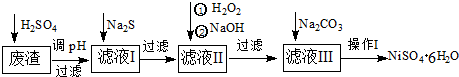
(1)加入Na2S是除去铜、锌等杂质,请写出除去Cu2+的离子方程式 .
(2)加6%的H2O2时,温度不能过高,也不宜过低,其目的是: .
(3)除铁方法:先用H2O2充分氧化后,再加NaOH控制pH值3~4范围内生成氢氧化铁沉淀.在上述方法中,可用NaClO3代替H2O2,请写出用氯酸钠氧化Fe2+的离子方程式为: .
(4)上述流程中滤液Ⅲ的主要成分是: .
(5)操作Ⅰ包括以下过程:过滤,用 (填试剂名称)溶解, ,洗涤获得产品.

(1)加入Na2S是除去铜、锌等杂质,请写出除去Cu2+的离子方程式
(2)加6%的H2O2时,温度不能过高,也不宜过低,其目的是:
(3)除铁方法:先用H2O2充分氧化后,再加NaOH控制pH值3~4范围内生成氢氧化铁沉淀.在上述方法中,可用NaClO3代替H2O2,请写出用氯酸钠氧化Fe2+的离子方程式为:
(4)上述流程中滤液Ⅲ的主要成分是:
(5)操作Ⅰ包括以下过程:过滤,用
考点:物质分离和提纯的方法和基本操作综合应用
专题:
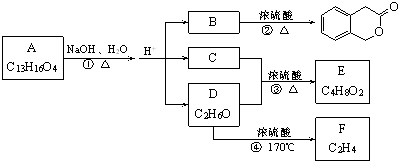
分析:废渣(除含镍外,还含有Cu、Zn、Fe、Cr等元素的化合物杂质),在硫酸溶解调节pH后过滤后除去不溶性物质,滤液含有二价铁离子、三价铬离子、铜离子、锌离子等杂质,加入硫化钠可除去铜离子、锌离子,然后加H2O2是将二价铁氧化成三价铁,加NaOH使三价铁和三价铬都以氢氧化物的沉淀而除去,滤液Ⅲ含有可溶性硫酸盐,为Na2SO4、NiSO4,再加碳酸钠沉淀二价镍,过滤、洗涤,然后与硫酸反应生成NiSO4晶体;
(1)加Na2S,易生成CuS沉淀;
(2)温度较高时,H2O2分解;
(3)ClO3-在酸性条件下具有强氧化性,与Fe2+发生氧化还原反应;
(4)经过加入Na2S、H2O2、NaOH后可除去Cu、Zn、Fe、Cr等杂质,滤液中含有可溶性硫酸盐;
(5)滤液Ⅲ加碳酸钠沉淀二价镍,过滤、洗涤,然后与硫酸反应生成NiSO4晶体.
(1)加Na2S,易生成CuS沉淀;
(2)温度较高时,H2O2分解;
(3)ClO3-在酸性条件下具有强氧化性,与Fe2+发生氧化还原反应;
(4)经过加入Na2S、H2O2、NaOH后可除去Cu、Zn、Fe、Cr等杂质,滤液中含有可溶性硫酸盐;
(5)滤液Ⅲ加碳酸钠沉淀二价镍,过滤、洗涤,然后与硫酸反应生成NiSO4晶体.
解答:
解:废渣(除含镍外,还含有Cu、Zn、Fe、Cr等元素的化合物杂质),在硫酸溶解调节pH后过滤后除去不溶性物质,滤液含有二价铁离子、三价铬离子、铜离子、锌离子等杂质,加入硫化钠可除去铜离子、锌离子,然后加H2O2是将二价铁氧化成三价铁,加NaOH使三价铁和三价铬都以氢氧化物的沉淀而除去,滤液Ⅲ含有可溶性硫酸盐,为Na2SO4、NiSO4,再加碳酸钠沉淀二价镍,过滤、洗涤,然后与硫酸反应生成NiSO4晶体;
(1)加Na2S,易生成CuS沉淀,反应的离子方程式为S2-+Cu2+=CuS↓,故答案为:S2-+Cu2+=CuS↓;
(2)温度较高时,H2O2分解,加6%的H2O2时,温度不能过高,也不宜过低,温度过低反应速率较小,故答案为:减少过氧化氢的分解,保证有一定的反应速率;
(3)ClO3-在酸性条件下具有强氧化性,与Fe2+发生氧化还原反应,反应的离子方程式为6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O,
故答案为:6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O;
(4)经过加入a2S、H2O2、NaOH后可除去Cu、Zn、Fe、Cr等杂质,滤液中含有可溶性硫酸盐,为Na2SO4、NiSO4,故答案为:Na2SO4、NiSO4;
(5)滤液Ⅲ加碳酸钠沉淀二价镍,过滤、洗涤,得到碳酸镍沉淀,然后与硫酸反应生成NiSO4晶体,把所得溶液蒸发浓缩,冷却结晶,过滤,洗涤获得产品,
故答案为:H2SO4;蒸发浓缩,冷却结晶,过滤.
(1)加Na2S,易生成CuS沉淀,反应的离子方程式为S2-+Cu2+=CuS↓,故答案为:S2-+Cu2+=CuS↓;
(2)温度较高时,H2O2分解,加6%的H2O2时,温度不能过高,也不宜过低,温度过低反应速率较小,故答案为:减少过氧化氢的分解,保证有一定的反应速率;
(3)ClO3-在酸性条件下具有强氧化性,与Fe2+发生氧化还原反应,反应的离子方程式为6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O,
故答案为:6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O;
(4)经过加入a2S、H2O2、NaOH后可除去Cu、Zn、Fe、Cr等杂质,滤液中含有可溶性硫酸盐,为Na2SO4、NiSO4,故答案为:Na2SO4、NiSO4;
(5)滤液Ⅲ加碳酸钠沉淀二价镍,过滤、洗涤,得到碳酸镍沉淀,然后与硫酸反应生成NiSO4晶体,把所得溶液蒸发浓缩,冷却结晶,过滤,洗涤获得产品,
故答案为:H2SO4;蒸发浓缩,冷却结晶,过滤.
点评:本题考查物质的分离提纯的实验方案的设计,侧重于学生的分析能力和实验能力的考查,题目难度较大,明确实验的目的和原理是解答该题的关键,注意把握基本实验操作.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目
下列有关实验原理或实验操作结论正确的是( )
| A、配制酸性KMnO4溶液时,用盐酸酸化 |
| B、用水湿润pH试纸测量某溶液的pH值 |
C、实验室用右图所示装置除去Cl2中的少量HCl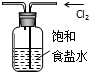 |
| D、用盐酸标准溶液滴定待测的氢氧化钠溶液时,水洗后的酸式滴定管未经标准液润洗,则测定结果偏低 |
常温下,下列各组粒子在指定体系中一定能大量共存的是( )
| A、遇苯酚变紫色的溶液:Na+、Mg2+、SO42-、H2O2 |
| B、0.1 mol?L-1 (NH4)2Fe(SO4)2溶液中:K+、Cu2+、Cl-、Fe3+ |
| C、使甲基橙变红色的溶液:NH4+、Cu2+、ClO-、Cl- |
| D、0.1mol?L-1 NaHCO3溶液:K+、AlO2-、Cl-、NO3- |