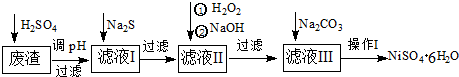
题目内容
有4种质量比可能相同或不同的镁铝合金样品①、②、③、④.甲、乙、丙、丁4位同学各取1种样品,进行下列实验,测定合金中镁的质量分数.
(1)甲同学取样品①m1 g和过量的氢氧化钠溶液反应,然后过滤;再往滤液中通入过量的二氧化碳气体,将所得沉淀过滤、洗涤、烘干、灼烧,得到固体质量仍为m1 g.则样品①合金中镁的质量分数为 .
(2)乙同学取样品②m2 g和足量的盐酸反应,然后滴加过量的氢氧化钠溶液,将沉淀过滤、洗涤、烘干、灼烧,得到固体质量仍为m2 g.则样品②合金中镁的质量分数为 .
(3)丙同学取样品③m3 g和足量的稀硫酸反应,发现固体完全溶解,标准状况下得到气体体积为V L,则样品③中m3的取值范围是 .
丁同学取不同质量的样品④分别和30mL同浓度的盐酸反应,所取合金质量与产生气体体积(已转化为标准状况)如下表:
(4)通过计算求该盐酸的物质的量浓度.
(5)通过计算求样品④中合金中镁的质量分数.
(6)在c组实验后,还需向容器中加入1.0mol?L-1的氢氧化钠溶液多少毫升才能使剩余合金中的铝恰好完全溶解?
(1)甲同学取样品①m1 g和过量的氢氧化钠溶液反应,然后过滤;再往滤液中通入过量的二氧化碳气体,将所得沉淀过滤、洗涤、烘干、灼烧,得到固体质量仍为m1 g.则样品①合金中镁的质量分数为
(2)乙同学取样品②m2 g和足量的盐酸反应,然后滴加过量的氢氧化钠溶液,将沉淀过滤、洗涤、烘干、灼烧,得到固体质量仍为m2 g.则样品②合金中镁的质量分数为
(3)丙同学取样品③m3 g和足量的稀硫酸反应,发现固体完全溶解,标准状况下得到气体体积为V L,则样品③中m3的取值范围是
丁同学取不同质量的样品④分别和30mL同浓度的盐酸反应,所取合金质量与产生气体体积(已转化为标准状况)如下表:
| 实验序号 | a | b | c |
| 合金质量/mg | 510 | 765 | 918 |
| 气体体积/mL | 560 | 672 | 672 |
(5)通过计算求样品④中合金中镁的质量分数.
(6)在c组实验后,还需向容器中加入1.0mol?L-1的氢氧化钠溶液多少毫升才能使剩余合金中的铝恰好完全溶解?
考点:探究物质的组成或测量物质的含量,镁的化学性质,铝的化学性质
专题:实验探究和数据处理题,计算题
分析:(1)发生的反应为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑、NaAlO2+CO2+2H2O=NaHCO3+Al(OH)3↓、2Al(OH)3
Al2O3+3H2O,得到的固体是氧化铝,反应前后质量不变,说明氧化铝中的氧元素质量分数等于镁元素质量分数;
(2)取样品②m2 g和足量的盐酸反应,然后滴加过量的氢氧化钠溶液,将沉淀过滤、洗涤、烘干、灼烧,发生反应为:2Al+6HCl=2AlCl3+3H2↑、Mg+2HCl=MgCl2+3H2↑、AlCl3+4NaOH=NaAlO2+3NaCl+2H2O、MgCl2+2NaOH=Mg(OH)2↓+2NaCl、Mg(OH)2
MgO+H2O,得到固体质量仍为m2 g,说明氧化镁中的氧元素质量分数等于铝元素质量分数;
(3)采用极限法计算固体质量范围;
(4)先判断盐酸是否完全反应,若盐酸完全反应,根据氢气求出消耗的盐酸,再求出浓度;
(5)根据表中数据可知,a组中金属完全反应,根据金属的总质量和生成氢气的物质的量列方程组,计算;
(6)根据方程式中转化关系以及原子守恒计算.
| ||
(2)取样品②m2 g和足量的盐酸反应,然后滴加过量的氢氧化钠溶液,将沉淀过滤、洗涤、烘干、灼烧,发生反应为:2Al+6HCl=2AlCl3+3H2↑、Mg+2HCl=MgCl2+3H2↑、AlCl3+4NaOH=NaAlO2+3NaCl+2H2O、MgCl2+2NaOH=Mg(OH)2↓+2NaCl、Mg(OH)2
| ||
(3)采用极限法计算固体质量范围;
(4)先判断盐酸是否完全反应,若盐酸完全反应,根据氢气求出消耗的盐酸,再求出浓度;
(5)根据表中数据可知,a组中金属完全反应,根据金属的总质量和生成氢气的物质的量列方程组,计算;
(6)根据方程式中转化关系以及原子守恒计算.
解答:
解:(1)发生的反应为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑、NaAlO2+CO2+2H2O=NaHCO3+Al(OH)3↓、2Al(OH)3
Al2O3+3H2O,得到的固体是氧化铝,反应前后质量不变,说明氧化铝中的氧元素质量分数等于镁元素质量分数,则合金中镁元素的质量分数=
×100%=47.06%,
故答案为:47.06%;
(2)取样品②m2 g和足量的盐酸反应,然后滴加过量的氢氧化钠溶液,将沉淀过滤、洗涤、烘干、灼烧,发生反应为:2Al+6HCl=2AlCl3+3H2↑、Mg+2HCl=MgCl2+3H2↑、AlCl3+4NaOH=NaAlO2+3NaCl+2H2O、MgCl2+2NaOH=Mg(OH)2↓+2NaCl、Mg(OH)2
MgO+H2O,得到固体质量仍为m2 g,说明氧化镁中的氧元素质量分数等于铝元素质量分数,则合金中铝元素的质量分数:
×100%=40%,则样品②合金中镁的质量分数为60%;
故答案为:60%;
(3)假设全部是Mg,设镁的质量为x,
Mg+2H+=Mg2++H2 ↑
24g 22.4L
x VL
=
x=0.80V;
假设合金全部是Al,
设铝的质量是y,
2Al+6H+=2Al2++3H2↑
54g 67.2L
yg VL
=
,
y=1.07V,
因为是两种金属的合金,所以0.80V<m<1.07V;
故答案为:0.80V<m<1.07V;
(4)bc中生成的气体体积相同,c中金属的质量较大,则c中盐酸反应完全,n(H2)=0.672/22.4=0.03 mol,
则c(HCl)=
=2.0 mol?L-1,
答:该盐酸的物质的量浓度为:2.0 mol?L-1;
(5)设合金中Mg、Al的物质的量分别为xmol、ymol,则有:
24x+27y=0.510g
x+
y=
解得:x=y=0.01 mol;
则w(Mg)=
×100%=47.06%;
答:样品④中合金中镁的质量分数为47.06%;
(6)盐酸最终转化为NaCl,Al转化为NaAlO2,则由HCl~NaCl和Al~NaAlO2可知
n(NaCl)=n(HCl)=2.0 mol?L-1×0.030 L=0.06 mol;
n(NaAlO2)=n(Al)=0.01 mol×918/510=0.018 mol;
根据Na+守恒得:n(NaOH)=0.06 mol+0.018 mol=0.078 mol;
故V(NaOH)=0.078 mol/1.0 mol?L-1=0.078 L=78 mL;
答:c组实验后还需加入78 mL的氢氧化钠溶液,才能使剩余合金中的铝恰好完全溶解.
| ||
| 16×3 |
| 16×3+27×2 |
故答案为:47.06%;
(2)取样品②m2 g和足量的盐酸反应,然后滴加过量的氢氧化钠溶液,将沉淀过滤、洗涤、烘干、灼烧,发生反应为:2Al+6HCl=2AlCl3+3H2↑、Mg+2HCl=MgCl2+3H2↑、AlCl3+4NaOH=NaAlO2+3NaCl+2H2O、MgCl2+2NaOH=Mg(OH)2↓+2NaCl、Mg(OH)2
| ||
| 16 |
| 16+24 |
故答案为:60%;
(3)假设全部是Mg,设镁的质量为x,
Mg+2H+=Mg2++H2 ↑
24g 22.4L
x VL
| 24g |
| xg |
| 22.4L |
| VL |
x=0.80V;
假设合金全部是Al,
设铝的质量是y,
2Al+6H+=2Al2++3H2↑
54g 67.2L
yg VL
| 54g |
| yg |
| 67.2L |
| VL |
y=1.07V,
因为是两种金属的合金,所以0.80V<m<1.07V;
故答案为:0.80V<m<1.07V;
(4)bc中生成的气体体积相同,c中金属的质量较大,则c中盐酸反应完全,n(H2)=0.672/22.4=0.03 mol,
则c(HCl)=
| 0.03mol×2 |
| 0.03L |
答:该盐酸的物质的量浓度为:2.0 mol?L-1;
(5)设合金中Mg、Al的物质的量分别为xmol、ymol,则有:
24x+27y=0.510g
x+
| 3 |
| 2 |
| 0.560L |
| 22.4L/mol |
解得:x=y=0.01 mol;
则w(Mg)=
| 0.01mol×24g?mol-1 |
| 0.510g |
答:样品④中合金中镁的质量分数为47.06%;
(6)盐酸最终转化为NaCl,Al转化为NaAlO2,则由HCl~NaCl和Al~NaAlO2可知
n(NaCl)=n(HCl)=2.0 mol?L-1×0.030 L=0.06 mol;
n(NaAlO2)=n(Al)=0.01 mol×918/510=0.018 mol;
根据Na+守恒得:n(NaOH)=0.06 mol+0.018 mol=0.078 mol;
故V(NaOH)=0.078 mol/1.0 mol?L-1=0.078 L=78 mL;
答:c组实验后还需加入78 mL的氢氧化钠溶液,才能使剩余合金中的铝恰好完全溶解.
点评:本题考查了合金的有关计算,明确物质之间的反应结合方程式来分析解答,注意根据反应方程式及结合原子守恒进行计算,题目难度较大.

练习册系列答案
相关题目
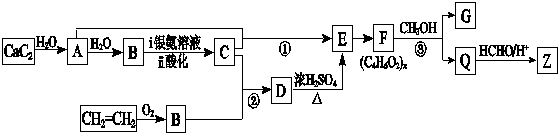
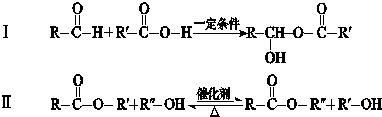
 RO-CH2-OR
RO-CH2-OR