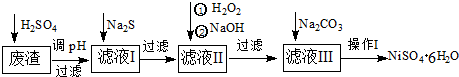
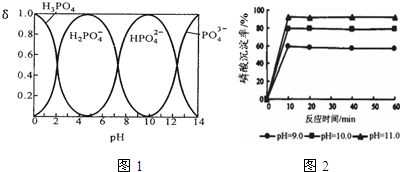
题目内容
常温下,下列各组粒子在指定体系中一定能大量共存的是( )
| A、遇苯酚变紫色的溶液:Na+、Mg2+、SO42-、H2O2 |
| B、0.1 mol?L-1 (NH4)2Fe(SO4)2溶液中:K+、Cu2+、Cl-、Fe3+ |
| C、使甲基橙变红色的溶液:NH4+、Cu2+、ClO-、Cl- |
| D、0.1mol?L-1 NaHCO3溶液:K+、AlO2-、Cl-、NO3- |
考点:离子共存问题
专题:
分析:A.遇苯酚变紫色的溶液含有Fe3+,为H2O2分解的催化剂;
B.如离子之间不发生任何反应,则可大量共存;
C.使甲基橙变红色的溶液呈酸性;
D.与HCO3-反应的离子不能大量共存.
B.如离子之间不发生任何反应,则可大量共存;
C.使甲基橙变红色的溶液呈酸性;
D.与HCO3-反应的离子不能大量共存.
解答:
解:A.遇苯酚变紫色的溶液含有Fe3+,为H2O2分解的催化剂,H2O2不能大量存在,故A错误;
B.0.1 mol?L-1 (NH4)2Fe(SO4)2溶液中,离子之间不发生任何反应,可大量共存,故B正确;
C.使甲基橙变红色的溶液呈酸性,酸性条件下,ClO-不能大量共存,故C错误;
D.AlO2-与HCO3-反应,不能大量共存,故D错误.
故选B.
B.0.1 mol?L-1 (NH4)2Fe(SO4)2溶液中,离子之间不发生任何反应,可大量共存,故B正确;
C.使甲基橙变红色的溶液呈酸性,酸性条件下,ClO-不能大量共存,故C错误;
D.AlO2-与HCO3-反应,不能大量共存,故D错误.
故选B.
点评:本题考查离子的共存,为高考高频考点,侧重氧化还原反应的离子共存问题的考查,注意信息的抽取和应用,选项D为解答的难点,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列说法中,不正确的是( )
| A、在其他条件不变时,对于反应2SO2(g)+O2(g)?2SO3(g)起始SO2与 O2按1:1的投料比加入,反应达到平衡后,若继续通入SO2,反应重新达平衡后,则SO3体积分数增大 |
| B、因常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)很容易进行,故该反应的△H<0 |
| C、在其他条件不变时,向H2(g)+I2(g)?2HI(g)平衡体系中加催化剂,反应速率加快,I2转化率不变 |
| D、14CO2与碳在高温条件下发生反应:CO2+C?2CO达到化学平衡后,平衡混合物中含14C的微粒有CO2、C、CO |