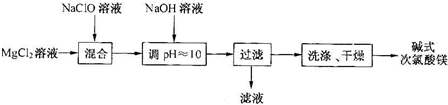
题目内容
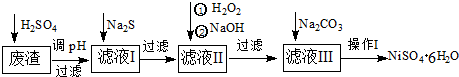
某电镀铜厂有两种废水需要处理,一种废水中含有CN-离子,另一种废水中含有Cr2O72-离子.该厂拟定如图所示的废水处理流程.
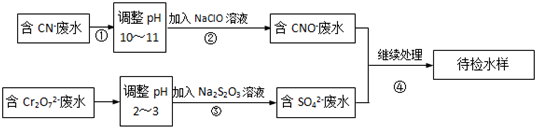
回答以下问题:
(1)上述处理废水的流程中主要使用的方法是 .
(2)②中使用的NaClO溶液呈碱性,用离子方程式解释原因 .
(3)②中反应后无气体放出,该反应的离子方程式为 .
(4)③中反应时,每0.4mol Cr2O72-转移2.4mol e-,该反应的离子方程式为 .
(5)取少量待检水样于试管中,先加入NaOH溶液,观察到有蓝色沉淀生成,继续加入NaOH溶液,直到不再产生蓝色沉淀为止,再加入Na2S溶液,有黑色沉淀生成,且蓝色沉淀逐渐减少.待检水样中还有 ,判定原因 ,再加入Na2S溶液,有黑色沉淀生成,请你使用化学用语,结合必要的文字解释其原因
.

回答以下问题:
(1)上述处理废水的流程中主要使用的方法是
(2)②中使用的NaClO溶液呈碱性,用离子方程式解释原因
(3)②中反应后无气体放出,该反应的离子方程式为
(4)③中反应时,每0.4mol Cr2O72-转移2.4mol e-,该反应的离子方程式为
(5)取少量待检水样于试管中,先加入NaOH溶液,观察到有蓝色沉淀生成,继续加入NaOH溶液,直到不再产生蓝色沉淀为止,再加入Na2S溶液,有黑色沉淀生成,且蓝色沉淀逐渐减少.待检水样中还有
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:(1)由转化图及图中的物质可知,NaClO、Cr2O72-离子都具有氧化性,则实现离子的转化是利用氧化还原反应实现的;
(2)利用盐的水解来分析盐溶液显碱性的原因;
(3)CN-离子具有还原性、NaClO具有氧化性,利用氧化还原来分析,并注意无气体生成来判断生成物;
(4)利用每0.4molCr2O72-转移2.4mol的电子来计算被还原后Cr元素的化合价,再书写离子方程式;
(5)根据铜离子与氢氧根离子反应生成沉淀及沉淀的转化来分析.
(2)利用盐的水解来分析盐溶液显碱性的原因;
(3)CN-离子具有还原性、NaClO具有氧化性,利用氧化还原来分析,并注意无气体生成来判断生成物;
(4)利用每0.4molCr2O72-转移2.4mol的电子来计算被还原后Cr元素的化合价,再书写离子方程式;
(5)根据铜离子与氢氧根离子反应生成沉淀及沉淀的转化来分析.
解答:
解:根据题目流程知道:废水处理过程中,调节pH,可以发生反应:CN-+ClO-═CNO-+Cl-,3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O,含有CNO-和SO42的水样继续处理即可得到待检水样.
(1)由图可知,将废水中的离子实现上述转化时,利用了氧化还原反应,则主要使用的方法为氧化还原法,故答案为:氧化还原法;
(2)NaClO溶液呈碱性,是因次氯酸根离子水解生成氢氧根离子导致的,则离子反应为ClO-+H2O HClO+OH-,故答案为:ClO-+H2O
HClO+OH-,故答案为:ClO-+H2O HClO+OH-;
HClO+OH-;
(3)碱性条件下,CN-离子与NaClO发生氧化还原反应,无气体放出,则生成CNO-、Cl-离子,离子反应为CN-+ClO-═CNO-+Cl-,故答案为:CN-+ClO-═CNO-+Cl-;
(4)每0.4molCr2O72-转移2.4mol的电子,设还原后Cr元素的化合价为x,则0.4mol×2×(6-x)=2.4mol,解得x=+3,则离子反应为3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O,
故答案为:3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O;
(5)因铜离子与氢氧根离子反应生成氢氧化铜沉淀,Cu2++2OH-═Cu(OH)2↓,CuS比Cu(OH)2更难溶,则加入Na2S溶液能发生沉淀的转化,Cu(OH)2(s)+S2-(aq)═CuS(s)+2OH-(aq),
故答案为:Cu2+;Cu2++2OH-=Cu(OH)2↓;Cu(OH)2(s)+S2-(aq)=CuS (s)+2OH-(aq);CuS比Cu(OH)2更难溶(或溶解度更小).
(1)由图可知,将废水中的离子实现上述转化时,利用了氧化还原反应,则主要使用的方法为氧化还原法,故答案为:氧化还原法;
(2)NaClO溶液呈碱性,是因次氯酸根离子水解生成氢氧根离子导致的,则离子反应为ClO-+H2O
 HClO+OH-,故答案为:ClO-+H2O
HClO+OH-,故答案为:ClO-+H2O HClO+OH-;
HClO+OH-; (3)碱性条件下,CN-离子与NaClO发生氧化还原反应,无气体放出,则生成CNO-、Cl-离子,离子反应为CN-+ClO-═CNO-+Cl-,故答案为:CN-+ClO-═CNO-+Cl-;
(4)每0.4molCr2O72-转移2.4mol的电子,设还原后Cr元素的化合价为x,则0.4mol×2×(6-x)=2.4mol,解得x=+3,则离子反应为3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O,
故答案为:3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O;
(5)因铜离子与氢氧根离子反应生成氢氧化铜沉淀,Cu2++2OH-═Cu(OH)2↓,CuS比Cu(OH)2更难溶,则加入Na2S溶液能发生沉淀的转化,Cu(OH)2(s)+S2-(aq)═CuS(s)+2OH-(aq),
故答案为:Cu2+;Cu2++2OH-=Cu(OH)2↓;Cu(OH)2(s)+S2-(aq)=CuS (s)+2OH-(aq);CuS比Cu(OH)2更难溶(或溶解度更小).
点评:本题是一道注重了化学与实际生产的联系的综合知识题,考查利用氧化还原反应来实现废水的转化,涉及实验操作,氧化还原反应等,明确该反应中的生成物是解本题关键,结合原子守恒、转移电子守恒来分析解答,题目难度中等.本题考查利用氧化还原反应来实现废水的转化,注重了化学与实际生产的联系,学生应学会利用物质的性质、元素的化合价、电子守恒等来解答.

练习册系列答案
相关题目
化学与生产、生活、社会密切相关,下列说法正确的是( )
| A、煤经气化和液化两个物理过程后可变为清洁能源,这是煤综合利用的主要方法 |
| B、蛋白质、淀粉、纤维素、油脂等都能在人体内水解并提供能量 |
| C、利用风能发电、使用太阳能热水器、应用无氟制冷剂均有利于降低大气中的二氧化碳 |
| D、钢筋混凝土、玻璃钢、石棉瓦、碳纤维增强陶瓷都是常见的复合材料 |
在氢硫酸溶液中,通入或加入少量的下列物质:①O2;②Cl2;③SO2;④CuSO4.能使溶液的导电能力增强的是( )
| A、①② | B、②④ | C、①④ | D、③④ |