题目内容
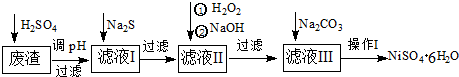
铝土矿的主要成分是Al2O3,还含有Fe2O3、SiO2等杂质,按下列操作从铝土矿中提取Al2O3,回答下列问题.
(1)沉淀物的化学式分别是:a ; f
(2)溶液b中所含的金属阳离子是 ;溶液c中必含的酸根阴离子是 .
(3)加入的试剂A是 ,通入的气体B是 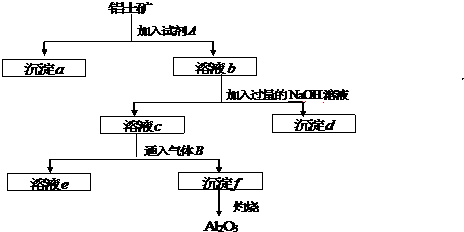
(1)沉淀物的化学式分别是:a
(2)溶液b中所含的金属阳离子是
(3)加入的试剂A是

考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:铝土矿的主要成分是Al2O3,还含有Fe2O3、SiO2等杂质,向铝土矿中加入试剂A生成沉淀a和溶液b,向溶液b中加入过量NaOH溶液得到沉淀d,则b中溶质为铁盐和铝盐,则a为SiO2,试剂A为酸;
溶液b中加入过量的NaOH溶液得到溶液c和沉淀d,d是Fe(OH)3,c中溶质为NaAlO2和NaOH,向溶液c中通入气体B,B是CO2,NaAlO2、NaOH和CO2反应生成碳酸钠或碳酸氢钠,同时生成沉淀f,f为Al(OH)3,据此分析解答.
溶液b中加入过量的NaOH溶液得到溶液c和沉淀d,d是Fe(OH)3,c中溶质为NaAlO2和NaOH,向溶液c中通入气体B,B是CO2,NaAlO2、NaOH和CO2反应生成碳酸钠或碳酸氢钠,同时生成沉淀f,f为Al(OH)3,据此分析解答.
解答:
解:土矿的主要成分是Al2O3,还含有Fe2O3、SiO2等杂质,向铝土矿中加入试剂A生成沉淀a和溶液b,向溶液b中加入过量NaOH溶液得到沉淀d,则b中溶质为铁盐和铝盐,则a为SiO2,试剂A为酸;
溶液b中加入过量的NaOH溶液得到溶液c和沉淀d,d是Fe(OH)3,c中溶质为NaAlO2和NaOH,向溶液c中通入气体B,B是CO2,NaAlO2、NaOH和CO2反应生成碳酸钠或碳酸氢钠,同时生成沉淀f,f为Al(OH)3
(1)通过以上分析知,a的化学式为SiO2,f的化学式为Al(OH)3,故答案为:SiO2;Al(OH)3;
(2)通过以上分析知,b中溶质为铁盐、铝盐,所以阳离子为Fe3+、Al3+,c中溶质为偏铝酸盐和NaOH,所以c中一定含有的酸根阴离子为AlO2-,
故答案为:Fe3+、Al3+;AlO2-;
(3)通过以上分析知,试剂A为酸,为稀盐酸或稀硫酸,B为 CO2,故答案为:稀盐酸或稀硫酸;CO2.
溶液b中加入过量的NaOH溶液得到溶液c和沉淀d,d是Fe(OH)3,c中溶质为NaAlO2和NaOH,向溶液c中通入气体B,B是CO2,NaAlO2、NaOH和CO2反应生成碳酸钠或碳酸氢钠,同时生成沉淀f,f为Al(OH)3
(1)通过以上分析知,a的化学式为SiO2,f的化学式为Al(OH)3,故答案为:SiO2;Al(OH)3;
(2)通过以上分析知,b中溶质为铁盐、铝盐,所以阳离子为Fe3+、Al3+,c中溶质为偏铝酸盐和NaOH,所以c中一定含有的酸根阴离子为AlO2-,
故答案为:Fe3+、Al3+;AlO2-;
(3)通过以上分析知,试剂A为酸,为稀盐酸或稀硫酸,B为 CO2,故答案为:稀盐酸或稀硫酸;CO2.
点评:本题考查物质分离和提纯,涉及Fe、Al元素化合物知识,明确物质的性质是解本题关键,根据b和NaOH的反应确定b成分,采用正逆结合的方法进行推断,熟练掌握常见元素化合物知识,知道每一步发生的反应及基本操作,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列说法中,不正确的是( )
| A、在其他条件不变时,对于反应2SO2(g)+O2(g)?2SO3(g)起始SO2与 O2按1:1的投料比加入,反应达到平衡后,若继续通入SO2,反应重新达平衡后,则SO3体积分数增大 |
| B、因常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)很容易进行,故该反应的△H<0 |
| C、在其他条件不变时,向H2(g)+I2(g)?2HI(g)平衡体系中加催化剂,反应速率加快,I2转化率不变 |
| D、14CO2与碳在高温条件下发生反应:CO2+C?2CO达到化学平衡后,平衡混合物中含14C的微粒有CO2、C、CO |


 RO-CH2-OR
RO-CH2-OR 已知1,2二氯乙烷常温下为无色液体,沸点83.5℃,密度1.23g/mL,难溶于水,易溶于醇、醚、丙酮等有机溶剂.乙醇的沸点为78.5℃.某化学课外活动小组为探究1,2二氯乙烷的消去反应,设计了如下实验装置.请回答下列问题.
已知1,2二氯乙烷常温下为无色液体,沸点83.5℃,密度1.23g/mL,难溶于水,易溶于醇、醚、丙酮等有机溶剂.乙醇的沸点为78.5℃.某化学课外活动小组为探究1,2二氯乙烷的消去反应,设计了如下实验装置.请回答下列问题.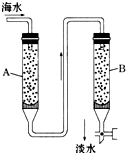 随着现代科学的不断发展,生产和生活所需淡水日益增多,甚至超过人类所能支配的淡水量,使地球上淡水资源发生危机,这就把海水淡化问题提到了科学家的面前.磺化媒(代表式NaR)是一种钠型离子交换树脂,它能使海水中的Ca2+、Mg2+交换除去.
随着现代科学的不断发展,生产和生活所需淡水日益增多,甚至超过人类所能支配的淡水量,使地球上淡水资源发生危机,这就把海水淡化问题提到了科学家的面前.磺化媒(代表式NaR)是一种钠型离子交换树脂,它能使海水中的Ca2+、Mg2+交换除去.