题目内容
3.如图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.通电一段时间后,在c电极上收集的气体为d电极上收集的气体的一半,且共收集到336mL气体(标况下).回答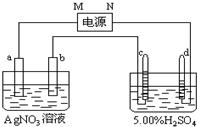
(1)直流电源中,M为正极.
(2)Pt电极上生成的物质是Ag,其质量为2.16g.
(3)电源输出的电子,其物质的量与电极b、c、d分别生成的物质的物质的量之比为:2:2:1:$\frac{1}{2}$.
(4)AgNO3溶液的浓度(填增大、减小或不变.下同)不变,H2SO4溶液的pH减小.
分析 (1)右边的池是电解水,在c电极上收集的气体为d电极上收集的气体的一半,所以c是氧气,d是氢气,则c是阳极,所以N是负极,M是正极;
(2)Pt电极是阴极,电解质溶液中的银离子放电生成单质银,根据转移电子数相等,求质量;
(3)共收集到336mL气体,所以整个电路转移电子的物质的量为:$\frac{336×1{0}^{-3}}{22.4}×\frac{2}{3}×2$=0.02mol,则b、c、d的物质的量分别为:0.02mol、$\frac{0.02}{2}mol$、$\frac{0.02}{4}mol$;(4)a极银放电,b极是角离子主放电,生成单质银,所以AgNO3溶液的浓度不变,右边的池是电解水,H2SO4溶液浓度变大,溶液pH减小.
解答 解:(1)右边的池是电解水,而d管中的体积比c管中的多,所以c是氧气,d是氢气,则c是阳极,所以N是负极,M是正极,故答案为:正;
(2)Pt电极是阴极,电解质溶液中的银离子放电生成单质银,由且共收集到336mL气体,
则3mol的气体~4Ag
3 4×108
$\frac{336×1{0}^{-3}}{22.4}$ m
m=$\frac{\frac{336×1{0}^{-3}}{22.4}×4×108}{3}$=2.16g,故答案为:Ag;2.16;
(3)共收集到336mL气体,所以整个电路转移电子的物质的量为:$\frac{336×1{0}^{-3}}{22.4}×\frac{2}{3}×2$=0.02mol,则b、c、d的物质的量分别为:0.02mol、$\frac{0.02}{2}mol$、$\frac{0.02}{4}mol$,即b、c、d分别生成的物质的物质的量之比为2:1:$\frac{1}{2}$,故答案为:2;1;$\frac{1}{2}$;
(4)a极银放电,b极是角离子主放电,生成单质银,所以AgNO3溶液的浓度不变,右边的池是电解水,H2SO4溶液浓度变大,溶液pH减小,故答案为:不变;减小.
点评 本题以电解池原理为载体考查了物质的量的有关计算、原电池正负极的判断等知识点,明确发生的电极反应及电子守恒是解答本题的关键,难度不大.

| A. | 淀粉碘化钾溶液加酸后变蓝:4I-+O2+4H+═2I2+2H2O | |
| B. | 向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+═2Fe(OH)3+3Mg2+ | |
| C. | 在Fe(NO3)2和KI组成的混合溶液中滴入少量稀盐酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O | |
| D. | 向NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液,可能发生的反应是:NH4++Fe3++2SO42-+2Ba2++4OH-═2BaSO4↓+NH3•H2O+Fe(OH)3↓ |
| A. | 1×10-5mol/L | B. | 1×10-12mol/L | C. | 1×10-6mol/L | D. | 1×10-7mol/L |
| A. | 每个水分子内含有两个氢键 | |
| B. | 只要有氢元素就能形成氢键 | |
| C. | 分子间能形成氢键使物质的熔点和沸点升高 | |
| D. | HF的稳定性很强,是因为其分子间能形成氢键 |
| A. | 乙烷可与氯气反应制取纯净的一氯乙烷 | |
| B. | 乙烯可以使溴水褪色 | |
| C. | 乙烷和乙烯互为同分异构体 | |
| D. | 乙烯制备聚乙烯是物理变化 |
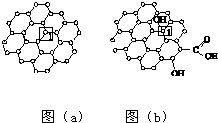 石墨烯[如图(a)所示]是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯[如图(b)所示].
石墨烯[如图(a)所示]是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯[如图(b)所示].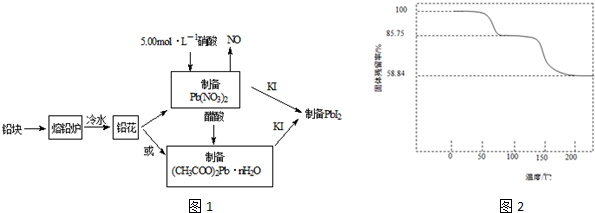
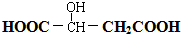 . 请回答:
. 请回答: .
.