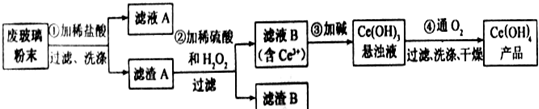
题目内容
3. 已知乙醇与浓硫酸加热到170℃时可生成乙烯:
已知乙醇与浓硫酸加热到170℃时可生成乙烯:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2═CH2↑+H2O
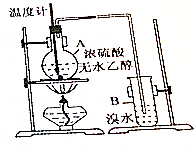
某兴趣小组利用该反应原理在实验室制取乙烯并探究乙烯和溴水的加成反应,实验装置如图所示.实验发现升温过程中A烧瓶内液体渐渐变黑,至170℃时生成气体速度明显加快,B中溶液逐渐褪色.实验完毕后,清洗烧瓶,烧瓶内附着少量黑色颗粒状物,有刺激性气味逸出.回答下列问题:
(1)烧瓶A中除加入无水乙醇和浓硫酸外还应加入碎瓷片或沸石,目的是防止液体暴沸
(2)分析使B中溶液褪色的物质,甲同学认为是C2H4,乙同学认为不能排除SO2的作用.
①根据甲同学的观点,使B中溶液褪色反应的化学方程式是CH2=CH2+Br2→CH2Br-CH2Br,该反应的反应类型是加成反应
②根据乙同学的观点,SO2使溶液褪色的反应中,SO2表现出的性质是还原性.
分析 实验室制取乙烯的原理是CH3CH2OH$→_{170℃}^{浓硫酸}$CH2═CH2↑+H2O,由于为液体的反应,且加热,为防止液体暴沸,应加入碎瓷片,实验发现升温过程中A烧瓶内液体渐渐变黑,乙醇被碳化,且与浓硫酸发生氧化还原反应生成二氧化硫,乙烯和二氧化硫都可与溴水反应,其中二氧化硫表现还原性,以此解答该题.
解答 解:(1)纯液体加热容易暴沸,一般需要加入碎瓷片或沸石防暴沸,故答案为:碎瓷片或沸石;防止液体暴沸;
(2)①根据甲的观点,溴水可以使B中溶液褪色,发生加成反应,反应的化学方程式是CH2=CH2+Br2→CH2Br-CH2Br,
故答案为:CH2=CH2+Br2→CH2Br-CH2Br;加成反应;
②乙根据现象认为产生了SO2,在B中溴单质可以和二氧化硫发生氧化还原反应,二氧化硫表现还原性,故答案为:还原性.
点评 本题考查实验室制取乙烯的装置及乙烯的性质,为高频考点,侧重于学生的分析、实验能力的考查,难度不大,只要把握住实验室制取乙烯的原理.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.一种熔融碳酸盐燃料电池原理示意如图.下列有关该电池的说法正确的是( )
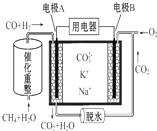

| A. | CH4+H2O$\frac{\underline{\;催化剂\;}}{△}$3 H2+CO,1 mol CH4参加反应转移12 mol电子 | |
| B. | 电极A为正极 | |
| C. | 电池工作时,CO32-向电极B移动 | |
| D. | O2在B电极上被还原 |
3.设NA为阿伏加德罗常数的数值.下列说法正确的是( )
| A. | 0.1mol•L-1的NaOH溶液中含Na+数目为0.1NA | |
| B. | 标准状况下,2.24L乙酸中含碳原子数目为0.2NA | |
| C. | 12gC60中含质子总数为6NA | |
| D. | 0.1molCl2与足量NaOH溶液反应,转移电子数目为0.2NA |
10.香豆素是一种天然香料,也可通过下列反应制备:

下列有关说法中正确的是( )

下列有关说法中正确的是( )
| A. | 该反应属于加成反应 | |
| B. | 水杨醛能被酸性高锰酸钾溶液氧化为水杨酸 | |
| C. | 可用新制的Cu(OH)2悬浊液区别水扬醛和香豆素 | |
| D. | 水杨醛、乙酸肝和香豆素都能发生水解反应 |
12.下列说法正确的是( )
| A. | 向1ml 1mol/L的NaOH的溶液中滴加1~2滴2mol/LMgCl2溶液有白色沉淀生成,再滴加2滴0.1mol/LFeCl3溶液,出现红褐色沉淀,则证明Mg(OH)2的Ksp大于Fe(OH)3 | |
| B. | 由pH=3的CH3COOH溶液和pH=11的NaOH溶液等体积混合后的溶液显酸性 | |
| C. | 由0.1mol/L的CH3COOH溶液和0.1mol/L的NaOH溶液等体积混合后的溶液显酸性 | |
| D. | 某物质的溶液中由水电离出的c(H+)=1×10-a mol/L,若a>7,则该溶液的pH一定为14-a |
13.草酸(H2C2O4)溶液与酸性KMnO4溶液反应时,溶液褪色总是先慢后快.某学习小组结合化学反应原理提出猜想与假设,并设计了一系列实验进行探究.
实验Ⅰ:在2支试管中分别加入5mL等浓度的H2C2O4溶液,在其中一支试管中先加入少量MnSO4固体再各加入5滴0.1mol•L-1KMnO4溶液.记录溶液褪色时间,如表1:
[表1]
实验Ⅱ:另取2支试管分别加入5mL等浓度的H2C2O4溶液,在其中一支试管中先加入10滴稀硫酸,再各加入5滴0.1mol•L-1 KMnO4溶液.记录溶液褪色时间,如表2:
[表2]
实验Ⅲ:另取3支试管分别加入5mL等浓度H2C2O4溶液,然后在试管中先分别加入10滴、1mL、2mL稀硫酸溶液,再各加入5滴0.1mol•L-1KMnO4溶液,然后置于温度为65℃的水浴中加热.记录溶液褪色时间,如表3:
[表3]
(1)实验Ⅰ得出的结论是Mn2+(或硫酸锰)在反应中起到催化剂的作用,加快了反应速率.
(2)比较实验Ⅱ、Ⅲ得出的结论正确的是:①②③.
①温度对该反应速率有影响
②硫酸对草酸和KMnO4溶液的反应有影响
③加入少量硫酸,可促进草酸和KMnO4溶液反应,而加入大量硫酸,反应速率比较小
④在酸性范围内,pH值越小对反应越有利
(3)写出草酸溶液与酸性KMnO4溶液反应的离子方程式:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O.实验室利用该反应标定未知浓度H2C2O4溶液,滴定终点的现象是:溶液颜色从无色变为浅紫红色,且30s不改变.滴定完成后仰视读取KMnO4溶液体积会导致测得H2C2O4溶液的浓度偏大(选填:偏大、偏小、无影响).
(4)有同学根据查阅的资料提出KMnO4溶液氧化H2C2O4的反应历程为:
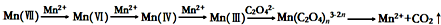
上述实验中,实验Ⅰ可证明这个历程是可信的.
实验Ⅰ:在2支试管中分别加入5mL等浓度的H2C2O4溶液,在其中一支试管中先加入少量MnSO4固体再各加入5滴0.1mol•L-1KMnO4溶液.记录溶液褪色时间,如表1:
| 试 管 | 未加MnSO4的试管 | 加有MnSO4的试管 |
| 褪色时间 | 30s | 2s |
实验Ⅱ:另取2支试管分别加入5mL等浓度的H2C2O4溶液,在其中一支试管中先加入10滴稀硫酸,再各加入5滴0.1mol•L-1 KMnO4溶液.记录溶液褪色时间,如表2:
| 试 管 | 未滴加稀硫酸的试管 | 滴加了稀硫酸的试管 |
| 褪色时间 | 100s | 90s |
实验Ⅲ:另取3支试管分别加入5mL等浓度H2C2O4溶液,然后在试管中先分别加入10滴、1mL、2mL稀硫酸溶液,再各加入5滴0.1mol•L-1KMnO4溶液,然后置于温度为65℃的水浴中加热.记录溶液褪色时间,如表3:
| 试 管 | 滴入10滴稀硫酸的试管 | 加入1mL稀硫酸的试管 | 加入2mL稀硫酸的试管 |
| 褪色时间 | 70s | 100s | 120s |
(1)实验Ⅰ得出的结论是Mn2+(或硫酸锰)在反应中起到催化剂的作用,加快了反应速率.
(2)比较实验Ⅱ、Ⅲ得出的结论正确的是:①②③.
①温度对该反应速率有影响
②硫酸对草酸和KMnO4溶液的反应有影响
③加入少量硫酸,可促进草酸和KMnO4溶液反应,而加入大量硫酸,反应速率比较小
④在酸性范围内,pH值越小对反应越有利
(3)写出草酸溶液与酸性KMnO4溶液反应的离子方程式:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O.实验室利用该反应标定未知浓度H2C2O4溶液,滴定终点的现象是:溶液颜色从无色变为浅紫红色,且30s不改变.滴定完成后仰视读取KMnO4溶液体积会导致测得H2C2O4溶液的浓度偏大(选填:偏大、偏小、无影响).
(4)有同学根据查阅的资料提出KMnO4溶液氧化H2C2O4的反应历程为:
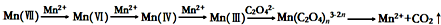
上述实验中,实验Ⅰ可证明这个历程是可信的.
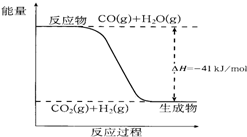 已知一氧化碳与水蒸气反应过程的能量变化如图所示:
已知一氧化碳与水蒸气反应过程的能量变化如图所示: