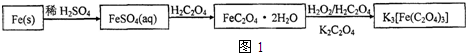
题目内容
5.下列变化需加氧化剂才能实现的是( )| A. | NH3→NH4+ | B. | N2→NH3 | C. | NH3→NO | D. | Cl2→Cl- |
分析 需加氧化剂才能实现,则选项中为还原剂的发生的氧化反应,还原剂中某元素的化合价升高,以此来解答.
解答 解:A.元素化合价不变,不是氧化还原反应,故A错误;
B.N元素化合价降低,应加入还原剂,故B错误;
C.N元素化合价升高,加入氧化剂可实现,故C正确;
D.Cl元素化合价降低,应加入还原剂,故D错误.
故选C.
点评 本题考查氧化还原反应,为高考常见题型,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应还原剂的考查,题目难度不大.

练习册系列答案
相关题目
16.下列化学反应的离子方程式错误的是( )
| A. | Al(OH)3与盐酸反应:Al(OH)3+3H+═Al3++3H2O | |
| B. | Al2O3溶于过量NaOH溶液:Al2O3+2OH-═2AlO2-+H2O | |
| C. | 铁溶于稀H2SO4中:2Fe+6H+═2Fe3++3H2↑ | |
| D. | Al(OH)3溶于NaOH溶液:Al(OH)3+OH-═AlO2-+2H2O |
13.在水电离出c(H+)=1.0×10-12mol/L的溶液中,一定能大量共存的离子组是( )
| A. | Na+、K+、Br-、NO3- | B. | K+、NH+4、CO32-、Br- | ||
| C. | Fe2+、Na+、MnO4-、Cl- | D. | Cu2+、Na+、Cl-、SO42- |
20.氯碱工业电解所用的氯化钠溶液需精制.除去有影响的Ca2+,Mg2+,NH4+,SO42-及泥沙,其精制流程如下:
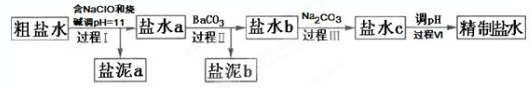
已知:①Ca2+,Mg2+开始形成相应氢氧化物沉淀的pH如表:
②Ksp(BaSO4)=1.1×10-10,Ksp(BaCO3)=2.6×10-9,Ksp(CaCO3)=5.0×10-9.
下列说法正确的是( )

已知:①Ca2+,Mg2+开始形成相应氢氧化物沉淀的pH如表:
| Ca(OH)2 | Mg(OH)2 | |
| pH | ≥11.5 | ≥4.2 |
下列说法正确的是( )
| A. | 盐泥a除泥沙外,还含有Ca(OH)2和Mg(OH)2 | |
| B. | 过程Ⅰ中NH4+转化为N2的离子方程式是3ClO-+2NH4+═3Cl-+N2↑+3H2O+2H+ | |
| C. | 过程Ⅱ中通入CO2有利于除SO42- | |
| D. | 过程Ⅳ调pH可以使用硝酸 |
10.下列各组元素的第一电离能按递增的顺序正确的是( )
| A. | Na Mg Al | B. | B C N | C. | Si P As | D. | He Ne Ar |
17.下列反应的离子方程式正确的是( )
| A. | 将铁粉加入稀硫酸中:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| C. | SiO2与NaOH溶液反应:SiO2+2OH-═SiO32-+H2O | |
| D. | 将氯气通入水中:Cl2+H2O═2H++Cl-+ClO- |
15.将SO2气体通入CaCl2溶液,若要有白色沉淀产生,可加入的试剂是( )
| A. | 氯化钾溶液 | B. | 碳酸氢钙溶液 | C. | 氯水 | D. | 氢氧化钠溶液 |