题目内容
13.高功率LaNi5H6 (氢的化合价为0价)电池已经用于混合动力汽车.总反应如下:LaNi5H6+6NiO(OH)$?_{充电}^{放电}$ LaNi5+6Ni(OH)2下列叙述正确的是( )| A. | 充电时储氢合金作阳极 | |
| B. | 充电时阳极周围pH增大 | |
| C. | 放电时负极反应:LaNi5H6+6OH--6e-═LaNi5+6H2O | |
| D. | 放电时每转移6mol电子,有6moLNiO(OH)被还原 |
分析 由LaNi5H6+6NiOOH?充电放电LaNi5+6Ni(OH)2可知,放电时,为原电池,正极反应为6NiOOH+6e-+6H2O=6Ni(OH)2+6OH-,负极反应为 LaNi5H6-6e-+6OH-=LaNi5+6H2O.由此可见储氢合金是还原剂,作原电池的负极.充电时,阳极反应为6Ni(OH)2+6OH-+6e-=6NiOOH+6H2O,阴极反应为LaNi5+6H2O-6e-=LaNi5H6+6OH-,据此分析.
解答 解:A、储氢合金为原电池的负极,则充电时应连接外加电源的负极为阴极,故A错误;
B、充电时,阳极反应为6Ni(OH)2+6OH-+6e-=6NiOOH+6H2O,pH减小,故B错误;
C、放电时,为原电池,负极反应为 LaNi5H6-6e-+6OH-=LaNi5+6H2O,故C正确;
D、放电时,正极反应为6NiOOH+6e-+6H2O=6Ni(OH)2+6OH-,每转移6mol电子,有6moLNiO(OH)被还原,故D正确;
故选CD.
点评 本题考查化学电源新型电池,题目难度中等,本题注意根据电池总反应式正确判断电极反应,并能书写电极反应式是解答该题的关键.

练习册系列答案
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案
相关题目
4.下列各组物质的分离、提纯或除杂,可采用相同的原理和操作方法的是( )
| A. | 除去苏打中混有的小苏打杂质;分离氯化钠固体中混有的碘单质 | |
| B. | 除去粗食盐中的泥沙;除去氯化钾中的二氧化锰 | |
| C. | 分离硝酸钾与氯化钠;除去氢氧化铁胶体中混有的氯化钠 | |
| D. | 除去二氧化碳中混有的少量二氧化硫;除去二氧化碳中混有的少量一氧化碳 |
1.用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A. | 分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA | |
| B. | 常温常压下,0.1mol铁在0.1molC12中充分燃烧,转移的电子数为0.3NA | |
| C. | 0.1mol/L的K2CO3溶液中CO32-数小于0.1NA | |
| D. |  0.5mol雄黄(As4S4,结构如图)含有NA个S-S键 |
5.下列反应水解方程式正确的是( )
| A. | AlCl3+3H2O═Al(OH)3+3HCl | |
| B. | Na2CO3+2H2O?H2CO3+2NaOH | |
| C. | 碳酸氢钠溶液:HCO3-+H2O?H2CO3+OH-- | |
| D. | NH4Cl溶于D2O中:NH4++D2O?NH3•D2O+H+. |
3.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,11.2 L Br2通入足量NaOH溶液充分反应转移电子数为0.5NA | |
| B. | 60 g SiO2中所含Si-O键数为2NA | |
| C. | 常温常压下,5.6 g环丙烷和聚乙烯的混合物中含有的碳原子数为0.4NA | |
| D. | 1 mol/L 13CH3OH溶液中溶质含有的中子数为15NA |
 在如图所示的装置中,若通直流电5min时,铜电极质量增加2.16g.试回答下列问题.
在如图所示的装置中,若通直流电5min时,铜电极质量增加2.16g.试回答下列问题.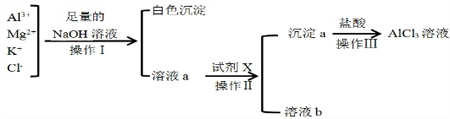 某校化学兴趣小组用如图所示过程除去AlCl3溶液中含有的Mg2+、K+杂质离子并尽可能减少AlCl3的损失
某校化学兴趣小组用如图所示过程除去AlCl3溶液中含有的Mg2+、K+杂质离子并尽可能减少AlCl3的损失 将16.8g碳酸氢钠与11.7g过氧化钠固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,得到残余固体X.
将16.8g碳酸氢钠与11.7g过氧化钠固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,得到残余固体X.