题目内容
8.下列各组离子在指定溶液中可能大量共存的是( )①无色透明溶液中:K+、Ca2+、MnO4-、SO42-
②pH=11的溶液中:CO32-、Na+、[Al(OH)]4-、NO3-
③加入Al能放出H2的溶液中:Cl-、HCO3-、SO42-、NH4+
④由水电离出的c(OH-)=10-4mol•L-1的溶液中:NH4+、Al3+、Cl-、Br-
⑤有较多Fe3+的溶液中:Na+、NH4+、SCN-、Cl-
⑥酸性溶液中:Fe2+、Al3+、NO3-、I-、Cl-.
| A. | ①②④ | B. | ③⑥ | C. | ②④ | D. | ①③⑤⑥ |
分析 ①无色溶液中不存在有色的高锰酸根离子;
②pH=11的溶液,显碱性,四种离子之间不反应,都不与氢氧根离子反应;
③加入Al能放出H2的溶液,为非氧化性酸或强碱溶液,碳酸氢根离子能够与氢离子和氢氧根离子反应;
④由水电离出的c(OH-)=10-4mol•L-1的溶液促进了水的电离,溶液中含有弱酸根或弱碱根离子;
⑤铁离子与硫氰根离子反应生成硫氰化铁;
⑥硝酸根离子在酸性条件下能够氧化亚铁离子、碘离子.
解答 解:①无色溶液中不存在有色的MnO4-,故①错误;
②pH=11的溶液,显碱性,CO32-、Na+、[Al(OH)]4-、NO3-离子之间不反应,都不与氢氧根离子反应,可大量共存,故②正确;
③加入Al能放出H2的溶液,为非氧化性酸或强碱溶液,HCO3-能够与酸和碱溶液反应,在溶液中一定不能大量共存,故③错误;
④由水电离出的c(OH-)=10-4mol•L-1的溶液促进了水的电离,含有弱酸根或弱碱根离子,NH4+、Al3+、Cl-、Br-之间不反应,NH4+或Al3+水解,促进了水的电离,满足条件,故④正确;
⑤Fe3+、SCN-反应生成络合物硫氰化铁,不能大量共存,故⑤错误;
⑥酸性溶液中NO3-能够氧化Fe2+、I-,不能大量共存,故⑥错误;
故选C.
点评 本题考查离子的共存,为高频考点,题目难度中等,明确习题中的信息及常见离子之间的反应为解答的关键,注意掌握离子反应发生条件,试题侧重复分解反应、氧化还原反应的离子共存考查.

练习册系列答案
相关题目
18.在某无色透明溶液中能大量共存的一组离子是( )
| A. | K+、Ba2+、NO3-、CO32- | B. | Cu2+、K+、NO3-、SO42- | ||
| C. | Na+、K+、Cl-、SO42- | D. | Fe2+、H+、Cl-、NO3- |
19.下列实验可达到实验目的是( )
| A. | 将苯与浓硝酸、浓硫酸的混合物在100℃水浴加热条件下反应可生成硝基苯 | |
| B. | 用酸性高锰酸钾溶液即可检验CH2═CH-CHO中的碳碳双键 | |
| C. | 将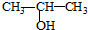 与NaOH的醇溶液共热制备CH3-CH═CH2 与NaOH的醇溶液共热制备CH3-CH═CH2 | |
| D. | 利用核磁共振氢谱,可以鉴别CH3OCH3和CH3CH2OH |
16.将甲、乙两种气体同时通入过量的丙溶液中,可能产生沉淀的组合是( )
| 序号 | 甲 | 乙 | 丙 |
| ① | CO2 | NO2 | Ca(OH)2 |
| ② | HCl | CO2 | Ca(OH)2 |
| ③ | NO2 | NH3 | MgCl2 |
| ④ | NO2 | O2 | BaCl2 |
| ⑤ | CO2 | NH3 | CaCl2 |
| A. | ①②③ | B. | ①④⑤ | C. | ①②③⑤ | D. | 全部 |
3.用含有Al2O3、SiO2和少量FeO•xFe2O3的铝灰制备Al2(SO4)3•18H2O,工艺流程如下(部分操作和条件略):
Ⅰ.向铝灰中加入过量稀H2SO4,过滤;
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.再经过一系列操作,分离得到产品.
(1)步骤Ⅰ中过滤所得滤渣主要成分为:SiO2,H2SO4溶解Al2O3的离子方程式为:Al2O3+6H+=2Al3++3H2O.
(2)步骤Ⅱ中加入KMnO4时发生反应的离子方程式为:MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O.
(3)已知:生成氢氧化物沉淀的pH
注:金属离子的起始浓度均为0.1mol•L-1
①根据表中数据解释步骤Ⅱ的目的:pH约为3时,Fe2+和Al3+不能形成沉淀,将Fe2+氧化为Fe3+,可使铁完全沉淀,
②当Al3+开始沉淀时,Fe3+的浓度约为:10-6.7 mol•L-1.
(4)已知:一定条件下,MnO4-可与Mn2+反应生成MnO2.
①向Ⅲ的沉淀中加入浓盐酸并加热,能说明沉淀中存在MnO2的现象是:生成黄绿色气体.
②步骤Ⅳ中加入MnSO4的目的是:除去过量的MnO4-;.
(5)步骤Ⅴ中“一系列操作”是蒸发浓缩、冷却结晶.
Ⅰ.向铝灰中加入过量稀H2SO4,过滤;
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.再经过一系列操作,分离得到产品.
(1)步骤Ⅰ中过滤所得滤渣主要成分为:SiO2,H2SO4溶解Al2O3的离子方程式为:Al2O3+6H+=2Al3++3H2O.
(2)步骤Ⅱ中加入KMnO4时发生反应的离子方程式为:MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O.
(3)已知:生成氢氧化物沉淀的pH
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
①根据表中数据解释步骤Ⅱ的目的:pH约为3时,Fe2+和Al3+不能形成沉淀,将Fe2+氧化为Fe3+,可使铁完全沉淀,
②当Al3+开始沉淀时,Fe3+的浓度约为:10-6.7 mol•L-1.
(4)已知:一定条件下,MnO4-可与Mn2+反应生成MnO2.
①向Ⅲ的沉淀中加入浓盐酸并加热,能说明沉淀中存在MnO2的现象是:生成黄绿色气体.
②步骤Ⅳ中加入MnSO4的目的是:除去过量的MnO4-;.
(5)步骤Ⅴ中“一系列操作”是蒸发浓缩、冷却结晶.
13.高功率LaNi5H6 (氢的化合价为0价)电池已经用于混合动力汽车.总反应如下:LaNi5H6+6NiO(OH)$?_{充电}^{放电}$ LaNi5+6Ni(OH)2下列叙述正确的是( )
| A. | 充电时储氢合金作阳极 | |
| B. | 充电时阳极周围pH增大 | |
| C. | 放电时负极反应:LaNi5H6+6OH--6e-═LaNi5+6H2O | |
| D. | 放电时每转移6mol电子,有6moLNiO(OH)被还原 |
17.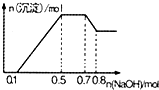 某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、Cl-中的几种,若向溶液中加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入的物质的量之间的关系如图所示,下列说法正确的是( )
某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、Cl-中的几种,若向溶液中加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入的物质的量之间的关系如图所示,下列说法正确的是( )
 某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、Cl-中的几种,若向溶液中加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入的物质的量之间的关系如图所示,下列说法正确的是( )
某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、Cl-中的几种,若向溶液中加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入的物质的量之间的关系如图所示,下列说法正确的是( )| A. | 溶液中的阳离子只有H+、Mg2+、Al3+ | |
| B. | 无法确定溶液中是否含有CO32-、SO42-和Cl- | |
| C. | 溶液中n(NH4+)=0.2mol | |
| D. | n(H+):n(Al3+):n(Mg2+)=1:1:1 |
18.在两个密闭容器中,分别充有质量相等的甲、乙两种气体,它们的温度和密度均相同.试根据甲、乙的摩尔质量(M)的关系,判断下列说法中正确的是( )
| A. | 若M(甲)>M(乙),则分子数:甲>乙 | B. | 若M(甲)<M(乙),则气体摩尔体积:甲>乙 | ||
| C. | 若M(甲)<M(乙),则气体的压强:甲>乙 | D. | 若M(甲)>M(乙),则气体体积:甲<乙 |
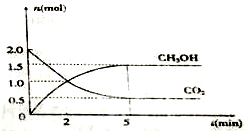 “低碳循环”引起了全世界的高度重视,减排CO2的一种方法是:
“低碳循环”引起了全世界的高度重视,减排CO2的一种方法是: