题目内容
15.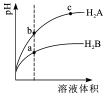 常温下,各取1mL,PH=2的,两种二元酸H2A与H2B,分别加水稀释,PH变化与加水稀释倍数有如图所示变化,则下列有关叙述正确的是( )
常温下,各取1mL,PH=2的,两种二元酸H2A与H2B,分别加水稀释,PH变化与加水稀释倍数有如图所示变化,则下列有关叙述正确的是( )| A. | H2A的酸性比H2B弱 | |
| B. | C点溶液的导电性比a、b点溶液的导电性都强 | |
| C. | 若0.1mol•L-1NaHA溶液的PH=4,离子浓度大小为c(Na+)>c(HA-)>c(A2-)>c(H2A)>c(H+)>c(OH-) | |
| D. | N2B的水溶液中,离子浓度大小为c(Na+)>c(B2-)>c(OH-)>c(H+) |
分析 A.弱酸中存在电离平衡,加水稀释促进弱酸电离,稀释时,如果是强酸,则溶液的pH增大多,弱酸pH增大的少;
B.溶液中氢离子浓度越大,导电性越强;
C.若0.1mol•L-1NaHA溶液的PH=4,溶液显酸性,HA-的电离程度大于水解程度;
D.H2B为弱酸,Na2B的水溶液显碱性.
解答 解:A.弱酸中存在电离平衡,加水稀释促进弱酸电离,稀释时,如果是强酸,则溶液的pH增大多,弱酸pH增大的少,所以H2A的酸性比H2B强,故A错误;
B.溶液中氢离子浓度越大,导电性越强,a点的pH最小,氢离子浓度最大,所以a点溶液的导电性最强,故B错误;
C.若0.1mol•L-1NaHA溶液的PH=4,溶液显酸性,HA-的电离程度大于水解程度,则c(A2-)>c(H2A),所以离子浓度大小为c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)>c(H2A),故C错误;
D.H2B为弱酸,Na2B的水溶液显碱性,则溶液中离子浓度大小为c(Na+)>c(B2-)>c(OH-)>c(H+),故D正确.
故选D.
点评 本题以弱电解质的电离为载体考查离子浓度大小比较,正确判断H2B的酸性强弱是解本题关键,根据溶质的性质结合电荷守恒、物料守恒来分析解答,题目难度中等.

练习册系列答案
相关题目
6.目前科学家们已经合成许多硫-氮化合物,其中一种结构如图所示.关于该物质说法正确的是( )

| A. | 该物质的分子式为SN | |
| B. | 该物质熔、沸点较低 | |
| C. | 该物质分子中所有原子的最外层均达到稳定结构 | |
| D. | 该物质与化合物S2N2互为同素异形体 |
3.下列说法正确的是( )
| A. | 玻璃容器可长期盛放各种酸 | |
| B. | 不能用浸泡过高锰酸钾溶液的硅藻土保鲜水果 | |
| C. | 食品保鲜膜、塑料水杯等生活用品的主要成分是聚氯乙烯 | |
| D. | 轮船水线以下的船壳上装有锌块能减缓船壳的腐蚀 |
10.化学在生产和日常生活中有着重要作用,下列有关说法不正确的是( )
| A. | 硅酸钠的水溶液俗称水玻璃,可用作木材防火剂 | |
| B. | “地沟油”禁止食用,但可以用来制肥皂 | |
| C. | 用聚乙烯塑料代替聚乳酸塑料可减少白色污染 | |
| D. | 利用粮食酿酒经过了淀粉→葡糖糖→乙醇的化学变化过程 |
7.下列过程均有沉淀生成,其中属于化学变化的是( )
| A. | 向蛋白质溶液中加入浓氯化铁溶液 | |
| B. | 两种不同品牌的墨水混合 | |
| C. | 向饱和BaSO4溶液中加入浓BaCl2溶液 | |
| D. | 向饱和Na2CO3溶液中通入CO2气体 |
4.下列离子方程式书写正确的是( )
| A. | 硫酸铜溶液吸收H2S:Cu2++S2-═CuS↓ | |
| B. | 磁性氧化铁溶于氢碘酸:Fe3O4+8H+═Fe2++2Fe3++4H2O | |
| C. | 向饱和碳酸钠溶液中通入足量CO2:CO32-+CO2+H2O═2HCO3- | |
| D. | 向KAl(SO4)2溶液中加入过量的Ba(OH)2溶液:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O |
14.下列物质类型中,前者包括后者的是( )
| A. | 溶液、分散系 | B. | 氧化物、化合物 | C. | 溶液、胶体 | D. | 化合物、电解质 |
 .
.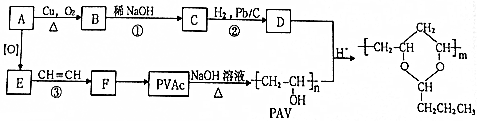

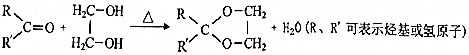
 ,该分子中最多有9个原子共平面;
,该分子中最多有9个原子共平面; $→_{△}^{NaOH}$
$→_{△}^{NaOH}$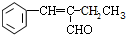 +H2O;
+H2O;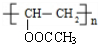 ;
;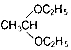 .
.