题目内容
4.下列离子方程式书写正确的是( )| A. | 硫酸铜溶液吸收H2S:Cu2++S2-═CuS↓ | |
| B. | 磁性氧化铁溶于氢碘酸:Fe3O4+8H+═Fe2++2Fe3++4H2O | |
| C. | 向饱和碳酸钠溶液中通入足量CO2:CO32-+CO2+H2O═2HCO3- | |
| D. | 向KAl(SO4)2溶液中加入过量的Ba(OH)2溶液:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O |
分析 A.硫化氢为气体,离子方程式中不能拆开;
B.铁离子具有氧化性,能够氧化碘离子;
C.碳酸氢钠的溶解度小于碳酸钠,反应后析出碳酸氢钠晶体;
D.氢氧化钡过量,反应生成硫酸钡沉淀、偏铝酸钾和水.
解答 解:A.硫酸铜溶液吸收H2S,硫化氢不能拆开,正确的离子方程式为:Cu2++H2S═CuS↓,故A错误;
B.磁性氧化铁溶于氢碘酸,二者发生氧化还原反应,正确的离子方程式为:2I-+Fe3O4+8H+=3Fe2++4H2O+I2,故B错误;
C.向饱和碳酸钠溶液中通入足量二氧化碳气体,正确的离子方程式:2Na++CO32-+H2O+CO2=2NaHCO3↓,故C错误;
D.向KAl(SO4)2溶液中加入过量的Ba(OH)2溶液,反应的离子方程式为:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O,故D正确;
故选D.
点评 本题考查了离子方程式的判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.

练习册系列答案
相关题目
14.下列现象属于物理变化的是( )
| A. | 潮解 | B. | 电解 | C. | 水解 | D. | 裂解 |
15.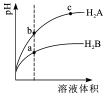 常温下,各取1mL,PH=2的,两种二元酸H2A与H2B,分别加水稀释,PH变化与加水稀释倍数有如图所示变化,则下列有关叙述正确的是( )
常温下,各取1mL,PH=2的,两种二元酸H2A与H2B,分别加水稀释,PH变化与加水稀释倍数有如图所示变化,则下列有关叙述正确的是( )
 常温下,各取1mL,PH=2的,两种二元酸H2A与H2B,分别加水稀释,PH变化与加水稀释倍数有如图所示变化,则下列有关叙述正确的是( )
常温下,各取1mL,PH=2的,两种二元酸H2A与H2B,分别加水稀释,PH变化与加水稀释倍数有如图所示变化,则下列有关叙述正确的是( )| A. | H2A的酸性比H2B弱 | |
| B. | C点溶液的导电性比a、b点溶液的导电性都强 | |
| C. | 若0.1mol•L-1NaHA溶液的PH=4,离子浓度大小为c(Na+)>c(HA-)>c(A2-)>c(H2A)>c(H+)>c(OH-) | |
| D. | N2B的水溶液中,离子浓度大小为c(Na+)>c(B2-)>c(OH-)>c(H+) |
12.Q、W、X、Y、Z是原子序数依次增大的短周期元素,Q和Y均满足主族序数与周期序数相等,Q与X、W与Z同主族,Q和W能形成原子个数之比为1:1和2:1的常见化合物.下列说法正确的是( )
| A. | 原子半径:Z>Y>X>W>Q | |
| B. | Q、X形成的化合物的电子式为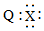 | |
| C. | 最简单氢化物的稳定性:Z>W | |
| D. | 工业上常用电解的方法制备X、Y的单质 |
19.化学与生产、生活、科技、环境等密切相关,下列说法错误的是( )
| A. | 利用CO2合成聚碳酸酯可降解塑料,实现“碳”的循环利用 | |
| B. | 氯水中加入稀硫酸,可增强氯水的漂白性 | |
| C. | 用蘸有浓氨水的玻璃棒检验输送氯气的管道是否漏气 | |
| D. | 加工后具有吸水性的植物纤维可用作食品干燥剂 |
9.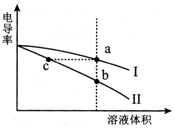 电导率是衡量电解质溶液导电能力大小的物理量.常温下,将相同体积的氢氧化钠溶液和醋酸溶液分别加水稀释,溶液的电导率随溶液体积变化的曲线如图所示.下列说法正确的是( )
电导率是衡量电解质溶液导电能力大小的物理量.常温下,将相同体积的氢氧化钠溶液和醋酸溶液分别加水稀释,溶液的电导率随溶液体积变化的曲线如图所示.下列说法正确的是( )
 电导率是衡量电解质溶液导电能力大小的物理量.常温下,将相同体积的氢氧化钠溶液和醋酸溶液分别加水稀释,溶液的电导率随溶液体积变化的曲线如图所示.下列说法正确的是( )
电导率是衡量电解质溶液导电能力大小的物理量.常温下,将相同体积的氢氧化钠溶液和醋酸溶液分别加水稀释,溶液的电导率随溶液体积变化的曲线如图所示.下列说法正确的是( )| A. | I表示NaOH溶液加水稀释过程中溶液电导率的变化 | |
| B. | a、b、c三点溶液的pH:b>c>a | |
| C. | 将a、b两点溶液混合,所得溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | a点水电离出的n(H+)等于c点水电离出的n(H+) |
2.下列化合物不能由单质之间直接化合得到的是( )
| A. | FeS | B. | SO3 | C. | FeCl3 | D. | NH3 |
3.最近医学界发现一种14C的羧酸衍生物在特定的条件下可通过断裂DNA杀死细胞,从而抑 制艾滋病,则下列关于14C的叙述正确的是( )
| A. | 其原子核内有8个中子 | B. | 是C60的同素异形体 | ||
| C. | 是14N的同素异形体 | D. | 与C60互为同位素 |