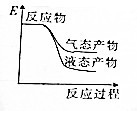
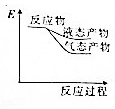
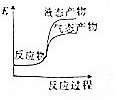
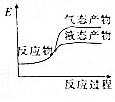
题目内容
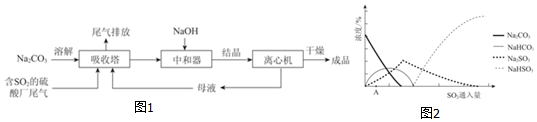
5.已知以下信息:①芳香烃A的相对分子质量在100~110之间,1molA充分燃烧可生成72g水;②C不能发生银镜反应.A$\stackrel{H_{2}O/H+}{→}$B$→_{△}^{O_{2}/Cu}$C
则A的化学名称为苯乙烯;由B生成C的化学方程式为
 .
.
分析 芳香烃A的相对分子质量在100~110之间,1mol A充分燃烧可生成72g水,72g水的物质的量=$\frac{72g}{18g/mol}$=4mol,所以1个A分子中含有8个氢原子,A能和水发生加成反应,则A中含有碳碳双键,B中含有羟基,B被氧化后生成C,C不能发生银镜反应,则C中不含醛基,则C中含有羰基,结合A的相对分子质量知,A是苯乙烯,B的结构简式为: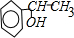 ,C的结构简式为:
,C的结构简式为: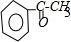 ,以此解答该题.
,以此解答该题.
解答 解:芳香烃A的相对分子质量在100~110之间,1mol A充分燃烧可生成72g水,72g水的物质的量=$\frac{72g}{18g/mol}$=4mol,所以1个A分子中含有8个氢原子,A能和水发生加成反应,则A中含有碳碳双键,B中含有羟基,B被氧化后生成C,C不能发生银镜反应,则C中不含醛基,则C中含有羰基,结合A的相对分子质量知,A是苯乙烯,B的结构简式为: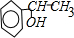 ,C的结构简式为:
,C的结构简式为: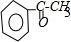 ,在加热、铜作催化剂条件下,B被氧气氧化生成C,反应方程式为:
,在加热、铜作催化剂条件下,B被氧气氧化生成C,反应方程式为: ,
,
故答案为:苯乙烯; .
.
点评 本题考查有机物的推断,为高频考点,侧重考查学生的分析能力,明确有机物反应时断键方式及官能团的性质是解本题关键,注意结合题给信息进行分析解答,难度中等.

练习册系列答案
相关题目
6.能正确表示下列反应的离子方程式是( )
| A. | 用石墨作电极电解CuCl2溶液:2Cl-+2H2O$\stackrel{电解}{→}$2OH-+Cl2↑+H2↑ | |
| B. | 0.01mol/LNH4Al(SO4)2溶液与0.02mol/LBa(OH)2溶液等体积混合:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O | |
| C. | 将少量二氧化硫通入次氯酸钠溶液:SO2+ClO-+2OH-═SO42-+Cl-+H2O | |
| D. | Ca(HCO3)2溶液与过量NaOH溶液反应:Ca2++HCO3-+OH-═CaCO3+H2O |
20.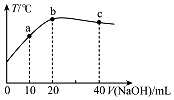 在一隔热系统中,向20.00mL 0.1000mol•L-1的醋酸溶液中逐滴加入0.1000mol.L-1的NaOH溶液,测得混合溶液的温度变化如图.下列相关说法正确的是( )
在一隔热系统中,向20.00mL 0.1000mol•L-1的醋酸溶液中逐滴加入0.1000mol.L-1的NaOH溶液,测得混合溶液的温度变化如图.下列相关说法正确的是( )
 在一隔热系统中,向20.00mL 0.1000mol•L-1的醋酸溶液中逐滴加入0.1000mol.L-1的NaOH溶液,测得混合溶液的温度变化如图.下列相关说法正确的是( )
在一隔热系统中,向20.00mL 0.1000mol•L-1的醋酸溶液中逐滴加入0.1000mol.L-1的NaOH溶液,测得混合溶液的温度变化如图.下列相关说法正确的是( )| A. | 若a点溶液呈酸性,此时:c(CH3COO-)-c(CH3COOH)=2c(H+)-2c(OH-) | |
| B. | B.从a到b:$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$逐渐增大 | |
| C. | 水的电离程度:b点<c点 | |
| D. | 溶液的pH值:a点<c点<b点 |
10.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 1mol甲基中含有电子数为10NA | |
| B. | 常温下,1LpH=12的Na2CO3溶液中含有的OH-离子数为0.01 NA | |
| C. | 标准状况下,NO和O2各11.2L混合充分反应,所得气体的分子总数为0.75 NA | |
| D. | 50mL12mol•L-1盐酸和足量MnO2共热,转移的电子数为0.3 NA |
14.下列现象属于物理变化的是( )
| A. | 潮解 | B. | 电解 | C. | 水解 | D. | 裂解 |
15.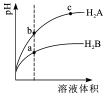 常温下,各取1mL,PH=2的,两种二元酸H2A与H2B,分别加水稀释,PH变化与加水稀释倍数有如图所示变化,则下列有关叙述正确的是( )
常温下,各取1mL,PH=2的,两种二元酸H2A与H2B,分别加水稀释,PH变化与加水稀释倍数有如图所示变化,则下列有关叙述正确的是( )
 常温下,各取1mL,PH=2的,两种二元酸H2A与H2B,分别加水稀释,PH变化与加水稀释倍数有如图所示变化,则下列有关叙述正确的是( )
常温下,各取1mL,PH=2的,两种二元酸H2A与H2B,分别加水稀释,PH变化与加水稀释倍数有如图所示变化,则下列有关叙述正确的是( )| A. | H2A的酸性比H2B弱 | |
| B. | C点溶液的导电性比a、b点溶液的导电性都强 | |
| C. | 若0.1mol•L-1NaHA溶液的PH=4,离子浓度大小为c(Na+)>c(HA-)>c(A2-)>c(H2A)>c(H+)>c(OH-) | |
| D. | N2B的水溶液中,离子浓度大小为c(Na+)>c(B2-)>c(OH-)>c(H+) |