题目内容
1.比较下列各组中两种元素金属性或非金属性的强弱金属性Na<K、金属性B<Al、非金属性P<Cl、非金属性S<Cl、非金属性O>S(1)Na、K;(2)B、Al;(3)P、Cl;(4)S、Cl;(5)O、S.
分析 同主族自上而下金属性逐渐增强、非金属性逐渐减弱,同周期自左而右金属性逐渐减弱,非金属性逐渐增强,据此进行判断.
解答 解:(1)Na、K处于同主族,同主族自上而下金属性增强,则金属性:Na<K,
故答案为:金属性Na<K;
(2)B、Al处于同主族,同主族自上而下金属性增强,则金属性:B<Al,
故答案为:金属性B<Al;
(3)P、Cl处于同周期,同周期自左而右非金属性增强,则非金属性:P<Cl,
故答案为:非金属性P<Cl;
(4)S、Cl处于同周期,同周期自左而右非金属性增强,则非金属性:S<Cl,
故答案为:非金属性S<Cl;
(5)O、S处于同一主族,同主族元素的非金属性逐渐减弱,则非金属性:O>S,
故答案为:非金属性O>S.
点评 本题考查了元素周期表、元素周期律的综合应用,题目难度不大,明确元素周期律的内容为解答关键,试题侧重基础知识的考查,培养了学生的灵活应用能力.

练习册系列答案
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案
相关题目
11.根据下列物质的化学性质,判断其应用错误的是( )
| A. | 镁燃烧发出耀眼的白光,可用来制造信号弹和焰火 | |
| B. | 碳酸氢钠能与酸反应,可用来治疗胃酸过多 | |
| C. | 利用铜与氯化铁溶液的反应来制作印刷电路板 | |
| D. | 铝制品表面有致密的氧化膜保护层,可长时间盛放咸菜等腌制食品 |
16.已知三氧化硫的熔点为16.8℃,沸点为44℃,下列有关三氧化硫的说法中,正确的是( )
| A. | 常温下SO3是液体 | |
| B. | 标准状况下,1 mol SO3的体积约为22.4L | |
| C. | SO3与CaO反应生成CaSO3 | |
| D. | SO2遇空气即生成SO3 |
6.下列有关化学用语表示正确的是( )
| A. | 1,3-丁二烯的实验式:C4H6 | B. | 乙醇的分子式:C2H5OH | ||
| C. | 甲醛的结构式: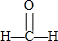 | D. | 聚丙烯的结构简式: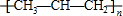 |
5.为了使CH3COONa溶液中Na+的浓度与CH3COO-的浓度比为1:1,可在CH3COONa溶液中加入( )
①适量的盐酸 ②适量的NaCl ③适量的醋酸 ④适量的CH3COONa.
①适量的盐酸 ②适量的NaCl ③适量的醋酸 ④适量的CH3COONa.
| A. | ①② | B. | ③ | C. | ③④ | D. | ④ |
2.离子检验的方法正确的是( )
| A. | 某溶液$\stackrel{+AgNO_{3}溶液}{→}$生成白色沉淀,说明原溶液中含有Cl- | |
| B. | 某溶$\stackrel{+HCl溶液}{→}$无现象$\stackrel{+BaCl_{2}溶液}{→}$生成白色沉淀,+说明原溶液中含有SO42- | |
| C. | 某溶$\stackrel{+NaOH溶液}{→}$生成红褐色沉淀,说明原溶液中含有Fe3+ | |
| D. | 某溶$\stackrel{+稀硫酸}{→}$生成无色气体,说明原溶液中含有CO32- |
3.下列物质属于共价化合物的是( )
| A. | CaO | B. | NH4Cl | C. | H2O | D. | NaCl |
 某课外活动小组同学用如图装置进行实验,一段时间后在C电极表面有铜析出,试回答下列问题.
某课外活动小组同学用如图装置进行实验,一段时间后在C电极表面有铜析出,试回答下列问题.