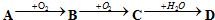题目内容
2.离子检验的方法正确的是( )| A. | 某溶液$\stackrel{+AgNO_{3}溶液}{→}$生成白色沉淀,说明原溶液中含有Cl- | |
| B. | 某溶$\stackrel{+HCl溶液}{→}$无现象$\stackrel{+BaCl_{2}溶液}{→}$生成白色沉淀,+说明原溶液中含有SO42- | |
| C. | 某溶$\stackrel{+NaOH溶液}{→}$生成红褐色沉淀,说明原溶液中含有Fe3+ | |
| D. | 某溶$\stackrel{+稀硫酸}{→}$生成无色气体,说明原溶液中含有CO32- |
分析 A.向一种未知溶液中加入硝酸银溶液,有白色沉淀生成,沉淀可能是AgCl或碳酸银沉淀;
B.加入的盐酸无现象,可以排除碳酸根、碳酸氢根离子的存在;
C.和氢氧化钠反应生成红褐色沉淀的金属阳离子是铁离子;
D.和硫酸反应能产生气体的离子可能为CO32-、HCO3-等离子.
解答 解:A.向一种未知溶液中加入硝酸银溶液,有白色沉淀生成,沉淀可能是AgCl或碳酸银沉淀,原溶液中不一定含有Cl-,故A错误;
B.加入的盐酸无现象,可以排除碳酸根、碳酸氢根离子的存在,再加入氯化钡,产生白色沉淀,而已证明硫酸根离子的存在,故B正确;
C.和氢氧化钠反应生成红褐色沉淀的金属阳离子是铁离子,据此可以检验铁离子的存在,故C正确;
D.和硫酸反应能产生气体的离子可能为CO32-、HCO3-等离子,故D错误.
故选BC.
点评 本题考查常见离子的检验方法,题目难度中等,明确常见离子的性质及检验方法为解答关键,注意判断离子是否存在时,需要排除干扰离子,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
7.科学家发现C60后,近年又合成了许多球形分子(富勒烯),如C50、C70、C120、C540等,有关他们的叙述正确的是( )
①互为同素异形体 ②属于同一种物质 ③富勒烯和足量氧气充分反应,最终产物不同④富勒烯都可以发生加成反应 ⑤富勒烯在苯中溶解度比在乙醇中溶解度大.
①互为同素异形体 ②属于同一种物质 ③富勒烯和足量氧气充分反应,最终产物不同④富勒烯都可以发生加成反应 ⑤富勒烯在苯中溶解度比在乙醇中溶解度大.
| A. | ①②③④⑤ | B. | ①②④⑤ | C. | ①④⑤ | D. | ①③④⑤ |
14. 氢气是一种清洁能源,氢气的制取是氢能源利用领域的研究热点;氢气也是重要的化工原料.
氢气是一种清洁能源,氢气的制取是氢能源利用领域的研究热点;氢气也是重要的化工原料.
(1)纳米级的Cu2O可作为太阳光分解水的催化剂.一定温度下,在2L密闭容器中加入纳米级Cu2O并通入0.10mol水蒸气发生反应:
2H2O(g)$?_{Cu_{2}O}^{光照}$2H2(g)+O2(g)△H=+484kJ•mol-1,不同时段产生O2的量见下表:
上述反应过程中能量转化形式为光能转化为化学能,达平衡过程中至少需要吸收光能为0.968kJ(保留三位小数).
(2)氢气是合成氨工业的原料,合成塔中每产生2mol NH3,放出92.2kJ热量.已知:则1mol N-H键断裂吸收的能量约等于391 kJ.
(3)已知:2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/molN2(g)+2O2(g)═2NO2(g)△H=+67.7kJ/mol则H2还原NO2生成水蒸气和氮气反应的热化学方程式是4H2(g)+2NO2(g)=N2(g)+4H2O(g)△H=-1034.9kJ/mol放电充电
(4)氢镍电池是近年开发出来的可充电电池,它可以取代会产生污染的铜镍电池.氢镍电池的总反应式是 H2+2NiO(OH)?2Ni(OH)2.请由总反应式回答:
①电解质溶液应该是碱溶液(选填酸溶液、碱溶液),
②电池放电时,负极反应式为H2-2e-+2OH-=2H2O,
③外电路中每通过0.2NA个电子时,H2的质量理论上减小0.2g,
④电池工作时,电子由负极通过外电路流向正极(选填正、负).
 氢气是一种清洁能源,氢气的制取是氢能源利用领域的研究热点;氢气也是重要的化工原料.
氢气是一种清洁能源,氢气的制取是氢能源利用领域的研究热点;氢气也是重要的化工原料.(1)纳米级的Cu2O可作为太阳光分解水的催化剂.一定温度下,在2L密闭容器中加入纳米级Cu2O并通入0.10mol水蒸气发生反应:
2H2O(g)$?_{Cu_{2}O}^{光照}$2H2(g)+O2(g)△H=+484kJ•mol-1,不同时段产生O2的量见下表:
| 时间/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 0.0010 | 0.0016 | 0.0020 | 0.0020 |
(2)氢气是合成氨工业的原料,合成塔中每产生2mol NH3,放出92.2kJ热量.已知:则1mol N-H键断裂吸收的能量约等于391 kJ.
(3)已知:2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/molN2(g)+2O2(g)═2NO2(g)△H=+67.7kJ/mol则H2还原NO2生成水蒸气和氮气反应的热化学方程式是4H2(g)+2NO2(g)=N2(g)+4H2O(g)△H=-1034.9kJ/mol放电充电
(4)氢镍电池是近年开发出来的可充电电池,它可以取代会产生污染的铜镍电池.氢镍电池的总反应式是 H2+2NiO(OH)?2Ni(OH)2.请由总反应式回答:
①电解质溶液应该是碱溶液(选填酸溶液、碱溶液),
②电池放电时,负极反应式为H2-2e-+2OH-=2H2O,
③外电路中每通过0.2NA个电子时,H2的质量理论上减小0.2g,
④电池工作时,电子由负极通过外电路流向正极(选填正、负).
11.已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4]-,铬的化合物有毒,由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍.因此,必须对含铬的废水进行处理,可采用以下两种方法.
还原法在酸性介质中用FeSO4等将+6价铬还原成+3价铬. 具体流程如下:

有关离子完全沉淀的pH如下表:
(1)写出Cr2O72-与FeSO4溶液在酸性条件下反应的离子方程式Cr2O72-+6Fe2++14H+═2 Cr3++6Fe3++7H2O.
(2)在含铬废水中加入FeSO4,再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀.
则在操作②中可用于调节溶液pH的试剂最好为:BD(填序号);
A.Na2O2B.Ca(OH)2C.Ba(OH)2D.NaOH
此时调节溶液的pH范围在C(填序号)最佳.
A.12~14B.10~11C.6~8D.3~4
(3)将等体积的4.0×10-3mol•L-1的AgNO3和4.0×10-3mol•L-1的K2CrO4溶液混合能析出Ag2CrO4沉淀(Ksp(Ag2CrO4)=9.0×10-12),请写出表示Ag2CrO4溶解平衡的方程式,并简要写出能生成Ag2CrO4沉淀原因的计算过程.
还原法在酸性介质中用FeSO4等将+6价铬还原成+3价铬. 具体流程如下:

有关离子完全沉淀的pH如下表:
| 有关离子 | Fe2+ | Fe3+ | Cr3+ |
| 完全沉淀为对应氢氧化物的pH | 9.0 | 3.2 | 5.6 |
(2)在含铬废水中加入FeSO4,再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀.
则在操作②中可用于调节溶液pH的试剂最好为:BD(填序号);
A.Na2O2B.Ca(OH)2C.Ba(OH)2D.NaOH
此时调节溶液的pH范围在C(填序号)最佳.
A.12~14B.10~11C.6~8D.3~4
(3)将等体积的4.0×10-3mol•L-1的AgNO3和4.0×10-3mol•L-1的K2CrO4溶液混合能析出Ag2CrO4沉淀(Ksp(Ag2CrO4)=9.0×10-12),请写出表示Ag2CrO4溶解平衡的方程式,并简要写出能生成Ag2CrO4沉淀原因的计算过程.
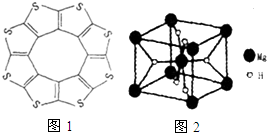 氢能被视为21世纪最具发展潜力的清洁能源.
氢能被视为21世纪最具发展潜力的清洁能源.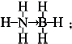 ;与氨硼烷互为等电子体的有机小分子是CH3CH3(写结构简式).
;与氨硼烷互为等电子体的有机小分子是CH3CH3(写结构简式).