题目内容
12. 某课外活动小组同学用如图装置进行实验,一段时间后在C电极表面有铜析出,试回答下列问题.
某课外活动小组同学用如图装置进行实验,一段时间后在C电极表面有铜析出,试回答下列问题.(1)B为电源的正极;
(2)在电解一段时间后在甲中加入适量CuO或CuCO3可以使溶液恢复到原来的浓度.
(3)在常温下,现用丙装置给铁镀铜,当丙中铁表面析出铜的3.2g时,乙中溶液的PH值为13(假设溶液体积为1L);
(4)利用反应2Cu+O2+2H2SO4═2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为4H++O2+4e-═2H2O.
分析 (1)在C电极表面有铜析出,则C为阴极,可知A为负极,B为正极;
(2)根据电解析出的物质,从而判断加入何种物质使溶液恢复到原来的浓度;
(3)整个装置中电子的得失数相等,根据E的电极反应求出产生的C(OH-),最终得到溶液的PH值;
(4)根据原电池原理,正极发生的是化合价降低得电子的反应.
解答 解:在C电极表面有铜析出,则C为阴极,可知A为负极,B为正极,则C、E、G为阴极,D、F、H为阳极,
(1)在C电极表面有铜析出,则C为阴极,可知A为负极,B为正极,故答案为:正极;
(2)甲中发生的反应:2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2+2H2SO4,由方程式知,电解出的物质有Cu和O2,所以加入CuO或CuCO3可以使溶液恢复到原来的浓度,但Cu(OH)2或碱式碳酸铜会使溶液变稀,不能恢复到原来的浓度,故答案为:CuO或CuCO3;
(3)n(Cu)=3.2g÷64g/mol=0.05mol,
丙中:Cu2++2e-=Cu
0.1mol 0.05mol
整个装置中电子的得失数相等,故乙中转移电子数也为0.1mol,
乙中的电解反应式为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,
阴极电极方程式为:2H2O+2e-=2OH-+H2↑,
0.1mol 0.1mol
故c(OH-)=0.1 mol/L,c(H+)=1×10-13 mol/L,pH=13,
故答案为:13;
(4)原电池正极发生的是化合价降低得电子的反应,根据方程式可知是O2得电子,另外,由于H2SO4存在,所以发生的O2酸性条件下的电极反应:4H++O2+4e-═2H2O,故答案为:4H++O2+4e-═2H2O.
点评 本题主要考查点解池的原理,为高频考点,侧重学生的分析、计算能力的考查,解题的关键是掌握电解池中离子的放电情况,即阳离子都是在阴极得电子放电,另外,抓住整个装置中电子得失相等,进行电解池中有关量的计算或判断,如:产物的量、溶液的PH、化学式等.

 阅读快车系列答案
阅读快车系列答案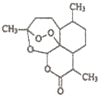 中国药学家屠呦呦因最早发现并提纯抗疟新药青蒿素而获得2015年度诺贝尔生理学或医学奖.已知青蒿素可从与青蒿同属的黄花蒿中提取,其结构如图所示,下列有关青蒿素说法不正确的是( )
中国药学家屠呦呦因最早发现并提纯抗疟新药青蒿素而获得2015年度诺贝尔生理学或医学奖.已知青蒿素可从与青蒿同属的黄花蒿中提取,其结构如图所示,下列有关青蒿素说法不正确的是( )| A. | 化学式为C15H20O5 | |
| B. | 能与NaOH溶液发生反应 | |
| C. | 与H2O2含有相似结构,具有杀菌作用 | |
| D. | 提取方法主要是低温萃取 |
| A. | 1:3 | B. | 1:4 | C. | 1:5 | D. | 1:6 |
①NaOH固体 ②硝酸钠溶液 ③H2O ④CH3COONa 固体 ⑤硫酸钾溶液.
| A. | ①③⑤ | B. | ③④⑤ | C. | ②③⑤ | D. | ②③④⑤ |
 氢气是一种清洁能源,氢气的制取是氢能源利用领域的研究热点;氢气也是重要的化工原料.
氢气是一种清洁能源,氢气的制取是氢能源利用领域的研究热点;氢气也是重要的化工原料.(1)纳米级的Cu2O可作为太阳光分解水的催化剂.一定温度下,在2L密闭容器中加入纳米级Cu2O并通入0.10mol水蒸气发生反应:
2H2O(g)$?_{Cu_{2}O}^{光照}$2H2(g)+O2(g)△H=+484kJ•mol-1,不同时段产生O2的量见下表:
| 时间/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 0.0010 | 0.0016 | 0.0020 | 0.0020 |
(2)氢气是合成氨工业的原料,合成塔中每产生2mol NH3,放出92.2kJ热量.已知:则1mol N-H键断裂吸收的能量约等于391 kJ.
(3)已知:2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/molN2(g)+2O2(g)═2NO2(g)△H=+67.7kJ/mol则H2还原NO2生成水蒸气和氮气反应的热化学方程式是4H2(g)+2NO2(g)=N2(g)+4H2O(g)△H=-1034.9kJ/mol放电充电
(4)氢镍电池是近年开发出来的可充电电池,它可以取代会产生污染的铜镍电池.氢镍电池的总反应式是 H2+2NiO(OH)?2Ni(OH)2.请由总反应式回答:
①电解质溶液应该是碱溶液(选填酸溶液、碱溶液),
②电池放电时,负极反应式为H2-2e-+2OH-=2H2O,
③外电路中每通过0.2NA个电子时,H2的质量理论上减小0.2g,
④电池工作时,电子由负极通过外电路流向正极(选填正、负).

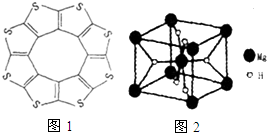 氢能被视为21世纪最具发展潜力的清洁能源.
氢能被视为21世纪最具发展潜力的清洁能源.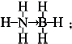 ;与氨硼烷互为等电子体的有机小分子是CH3CH3(写结构简式).
;与氨硼烷互为等电子体的有机小分子是CH3CH3(写结构简式).