题目内容
11.根据下列物质的化学性质,判断其应用错误的是( )| A. | 镁燃烧发出耀眼的白光,可用来制造信号弹和焰火 | |
| B. | 碳酸氢钠能与酸反应,可用来治疗胃酸过多 | |
| C. | 利用铜与氯化铁溶液的反应来制作印刷电路板 | |
| D. | 铝制品表面有致密的氧化膜保护层,可长时间盛放咸菜等腌制食品 |
分析 A.镁在空气中点燃,剧烈燃烧,发出耀眼的白光,放出大量的热;
B.碳酸氢钠能和盐酸反应;
C.金属铜具有还原性,能将铁离子还原为亚铁离子;
D.氯化钠也会破坏氧化膜的结构.
解答 解:A.镁在空气中点燃,剧烈燃烧,发出耀眼的白光,放出大量的热,生成白色固体氧化镁,镁是制造信号弹、焰火、闪光粉、轻质合金原料,故A正确;
B.碳酸氢钠能和盐酸反应,且由于碳酸氢钠是由于水解显的碱性,其碱性很弱,刺激性不大,故可以用于治疗胃酸过多,故B正确;
C.氯化铁溶液制作铜的印刷电路板,因为金属铜具有还原性,能将铁离子还原为亚铁离子,2Fe3++Cu═2Fe2++Cu2+,故C正确;
D.氧化铝虽然为致密的氧化物薄膜,但氯化钠也会破坏氧化膜的结构,从而加速铝制品的腐蚀,故D错误;
故选D.
点评 本题考查了化学与生活,明确反应原理是解本题关键,熟悉常见物质的性质,注意反应原理的理解应用,会运用化学知识解释生活现象,题目难度不大.

练习册系列答案
相关题目
1.叠氮酸(HN3)与醋酸酸性相似,下列叙述中错误的是( )
| A. | HN3水溶液中微粒浓度大小顺序为:c(HN3)>c(N${\;}_{3}^{-}$)>c(H+)>c(OH-) | |
| B. | HN3与NH3作用生成的叠氮酸铵是离子化合物 | |
| C. | NaN3水溶液中离子浓度大小顺序为:c(Na+)>c(N${\;}_{3}^{-}$)>c(OH-)>c(H+) | |
| D. | N${\;}_{3}^{-}$与CO2含相等电子数 |
2.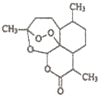 中国药学家屠呦呦因最早发现并提纯抗疟新药青蒿素而获得2015年度诺贝尔生理学或医学奖.已知青蒿素可从与青蒿同属的黄花蒿中提取,其结构如图所示,下列有关青蒿素说法不正确的是( )
中国药学家屠呦呦因最早发现并提纯抗疟新药青蒿素而获得2015年度诺贝尔生理学或医学奖.已知青蒿素可从与青蒿同属的黄花蒿中提取,其结构如图所示,下列有关青蒿素说法不正确的是( )
 中国药学家屠呦呦因最早发现并提纯抗疟新药青蒿素而获得2015年度诺贝尔生理学或医学奖.已知青蒿素可从与青蒿同属的黄花蒿中提取,其结构如图所示,下列有关青蒿素说法不正确的是( )
中国药学家屠呦呦因最早发现并提纯抗疟新药青蒿素而获得2015年度诺贝尔生理学或医学奖.已知青蒿素可从与青蒿同属的黄花蒿中提取,其结构如图所示,下列有关青蒿素说法不正确的是( )| A. | 化学式为C15H20O5 | |
| B. | 能与NaOH溶液发生反应 | |
| C. | 与H2O2含有相似结构,具有杀菌作用 | |
| D. | 提取方法主要是低温萃取 |
19.某同学探究氨和铵盐的性质,相关实验操作及现象描述正确的是( )
| A. | 室温下测定等浓度氨水和NaOH溶液的pH,比较氨水和NaOH碱性强弱 | |
| B. | 将氨水缓慢滴入AlCl3溶液中,研究Al(OH)3的两性 | |
| C. | 将蘸有浓氨水和浓硫酸的玻璃棒靠近,观察到白烟 | |
| D. | 加热除去NH4Cl中的少量NaHC03 |
16.日常饮用水中NO3-的含量是水质卫生检验的重要标准之一,达到一定浓度时会对人体健康产生危害.为了降低饮水中NO3-的浓度,某自来水厂设计了如下方案:
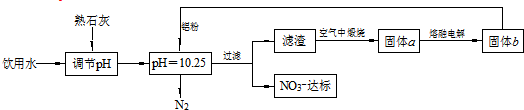
下列说法不正确的是( )

下列说法不正确的是( )
| A. | 该方案在调节pH时,若pH过大或过小都会造成Al的利用率降低 | |
| B. | 为了降低能耗,工业上往往用AlCl3代替固体a来制备固体b | |
| C. | 用熟石灰调节PH主要原因是价格便宜且引入的Ca2+对人体无害 | |
| D. | 在加入铝粉的反应中,氧化产物和还原产物的物质的量之比为10:3 |

 氢能被视为21世纪最具发展潜力的清洁能源.
氢能被视为21世纪最具发展潜力的清洁能源.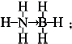 ;与氨硼烷互为等电子体的有机小分子是CH3CH3(写结构简式).
;与氨硼烷互为等电子体的有机小分子是CH3CH3(写结构简式).