题目内容
16.两种短周期元素组成的化合物中,原子个数比为1?:3,若两种元素的原子序数分别为a和b,则a和b的关系可能是( )①a=b+6 ②a+b=8 ③a+b=30 ④a=b+8.
| A. | ①②③ | B. | ①②④ | C. | ②③④ | D. | ①②③④ |
分析 两种短周期元素组成的化合物中原子数比为1:3,则化学式为AB3型,可能为第ⅢA族与ⅥⅠA组元素组成、可能为第ⅤA族和ⅥⅠA族元素组成、还可能为NH3或SO3,注意C2H6中原子数比为1:3,然后分析原子序数的关系.
解答 解:两种短周期元素组成的化合物中原子数比为1:3,则化学式为AB3型,
两种元素的原子序数分别是a和b,
若为NH3,则7=1+6,故①可能;
若为NH3,则7+1=8,故②可能;
若为AlCl3,则13+17=30,故③可能;
若为SO3,则16=8+8,故④可能;
显然①②③④都可能,
故选D.
点评 本题考查化合物中原子序数的关系,题目难度不大,明确常见的AB3型的化合物是解答本题的关键,本题中C2H6为学生思考容易遗漏的问题.

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目
6.下表是元素周期表的一部分,回答下列有关问题:
(1)元素⑦在元素周期表中的位置第三周期ⅥA族,画出⑥的原子结构示意图: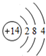 ,写出①的气态氢化物的分子式NH3.
,写出①的气态氢化物的分子式NH3.
(2)元素③、⑩的最高价氧化物水化物的碱性最强的为KOH;元素②、⑧的氢化物稳定性最强的是HF;表中①-⑫化学性质最稳定的是Ar(均用化学式填空).
(3)在水溶液中⑧的单质与⑫的简单阴离子可发生反应,其离子方程式为:Cl2+2Br-=2Cl-+Br2.
(4)③、⑤两种元素的最高价氧化物的水化物的离子方程式是:Al(OH)3+OH-=AlO2-+2H2O.
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
 ,写出①的气态氢化物的分子式NH3.
,写出①的气态氢化物的分子式NH3.(2)元素③、⑩的最高价氧化物水化物的碱性最强的为KOH;元素②、⑧的氢化物稳定性最强的是HF;表中①-⑫化学性质最稳定的是Ar(均用化学式填空).
(3)在水溶液中⑧的单质与⑫的简单阴离子可发生反应,其离子方程式为:Cl2+2Br-=2Cl-+Br2.
(4)③、⑤两种元素的最高价氧化物的水化物的离子方程式是:Al(OH)3+OH-=AlO2-+2H2O.
7.①~⑨是元素周期表中的部分元素.
请回答:
(1)元素⑤和⑦的最高价氧化物对应水化物反应的离子方程式是OH-+Al(OH)3=AlO2-+2H2O.
(2)用电子式表示元素⑥和⑨形成的化合物的过程 .
.
(3)某同学为了比较元素②和硅元素非金属性的相对强弱,用下图所示装置进行实验(夹持仪器已略去,气密性已检验).请回答:
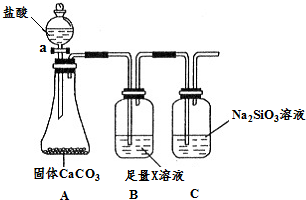
a.X是NaHCO3(填化学式),B装置的作用是吸收二氧化碳中混有的HCl气体.
b.能说明元素②和硅元素非金属性强弱的实验现象是C中产生白色胶状沉淀,相关的化学方程式是:CO2+H2O+Na2SiO3=Na2CO3+H2SiO3↓.
(4)请设计实验比较元素⑥与⑦金属性的相对强弱取一小段镁条和一小片铝片,磨去表面氧化膜,分别放入2支试管中,各加入等体积等浓度的盐酸,观察发生的现象.
族 周期 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
| 4 | ⑨ | |||||||
(1)元素⑤和⑦的最高价氧化物对应水化物反应的离子方程式是OH-+Al(OH)3=AlO2-+2H2O.
(2)用电子式表示元素⑥和⑨形成的化合物的过程
 .
.(3)某同学为了比较元素②和硅元素非金属性的相对强弱,用下图所示装置进行实验(夹持仪器已略去,气密性已检验).请回答:

a.X是NaHCO3(填化学式),B装置的作用是吸收二氧化碳中混有的HCl气体.
b.能说明元素②和硅元素非金属性强弱的实验现象是C中产生白色胶状沉淀,相关的化学方程式是:CO2+H2O+Na2SiO3=Na2CO3+H2SiO3↓.
(4)请设计实验比较元素⑥与⑦金属性的相对强弱取一小段镁条和一小片铝片,磨去表面氧化膜,分别放入2支试管中,各加入等体积等浓度的盐酸,观察发生的现象.
4.下列试剂是因为空气中的氧气而变质的是( )
| A. | 亚硫酸钠 | B. | 氢氧化钠 | C. | 过氧化钠 | D. | 碳酸氢钠 |
1.CH3CH2C≡CH的化学性质主要取决于( )
| A. | 碳碳单键(CC) | B. | 碳碳双键(CC) | C. | 碳碳三键(-C≡C-) | D. | 碳氢键(CH) |
5.已知X3-核外共有a个电子,X原子的质量数为b,则m g X3-含有中子的物质的量为( )
| A. | $\frac{m(b-a-3)}{b}$ | B. | $\frac{(b-a-3)}{mb}$ | C. | $\frac{m(b-a)}{b}$ | D. | $\frac{m(b-a+3)}{b}$ |
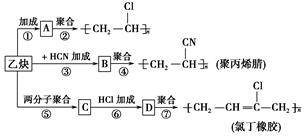

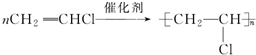 ;
;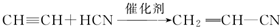 ;
;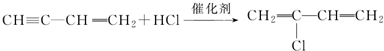 .
.