题目内容
15.几种短周期元素的原子半径及主要化合价如表:| 元素代号 | X | Y | Z | W |
| 原子半径/nm | 0.160 | 0.143 | 0.070 | 0.066 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
| A. | 元素的金属性:X<Y | |
| B. | 原子Z的价电子数为5 | |
| C. | 元素的简单离子半径:r(X2+)>r(W2-) | |
| D. | 元素Y的最高价氧化物对应的水化物能溶于氨水 |
分析 由表格中W只有-2价,可知W为O,结合Z的半径及化合价可知,Z为N元素;X、Y的原子半径大于Z、W,应为第三周期元素,X为+2价,Y为+3价,则X为Mg,Y为Al,以此来解答.
解答 解:由上述分析可知,X为Mg,Y为Al,Z为N,W为O,
A.同周期从左向右金属性减弱,则元素的金属性:X>Y,故A错误;
B.原子Z为N,最外层电子数为5,则价电子数为5,故B正确;
C.具有相同电子排布的离子中,原子序数大的离子半径小,则简单离子半径:r(X2+)<r(W2-),故C错误;
D.元素Y的最高价氧化物对应的水化物为氢氧化铝,不能溶于氨水,可溶于强碱溶液,故D错误;
故选B.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素的性质来推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案
相关题目
6.下列说法中正确的是( )
| A. | SO3与SO2分子空间结构不同,分子中S原子杂化方式也不同 | |
| B. | 乙烯分子中的碳氢键是氢原子的1s轨道和碳原子的一个sp3杂化轨道形成的 | |
| C. | 中心原子采取sp3杂化的分子,其几何构型可能是四面体形或三角锥形或V形 | |
| D. | AB2型的分子空间构型必为直线形 |
3.“凡酸坏之酒,皆可蒸烧”,“以烧酒复烧二次…,价值数倍也”,这里用到的分离方法为( )
| A. | 蒸馏 | B. | 升华 | C. | 萃取 | D. | 蒸发 |
10.利用如图所示装置进行实验,能实现实验目的是(必要时可加热)( )
| 选项 | 实验目的 | 甲 | 乙 | 丙 | 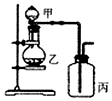 |
| A | 证明浓硫酸具有强氧化性 | 浓硫酸 | 碳粉 | 溴水 | |
| B | 验证Cl2无漂白性 | 浓盐酸 | MnO2 | 干燥的红色布条 | |
| C | 验证NH3溶于水显碱性 | 浓氨水 | 碱石灰 | 湿润的蓝色石蕊试纸 | |
| D | 比较H2CO3和H2SiO3的酸性 | 硼酸溶液 | 碳酸钠 | 硅酸钠溶液 |
| A. | A | B. | B | C. | C | D. | D |
20.含硫化合物在生产、生活中有较广泛的应用.请按要求回答下列问题.
I.“保险粉”(Na2S2O4)易溶于水、难溶于乙醇,具有极强的还原性,在空气中易被氧化,在碱性介质中稳定.它的制备工艺流程如图所示,请按要求回答下列问题.
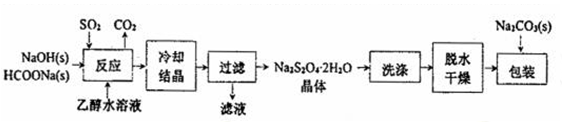
(1)“反应”在70℃条件下进行,写出发生反应的离子方程式:HCOO-+OH-+2SO2=S2O42-+CO2+H2O.
(2)在包装保存“保险粉”时加入少量的Na2CO3固体,目的是Na2CO3为碱性物质,提高“保险粉”的稳定性.
(3)现将10mL 0.050mol/L Na2S2O4溶液在空气中放置,其溶液的pH与时间(t)的关系如图所示:(忽略溶液体积的变化).
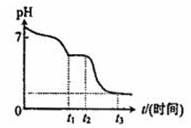
①t1~t2段溶液中S元素的化合价为+4.
②t3时刻后溶液的pH为1.
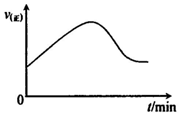
Ⅱ.由工业制硫酸反应之一:2SO2(g)+O2(g)$?_{加热}^{催化剂}$2SO3(g),推测此反应的△S(填“>”或“<”)<0,△H(填“>”或“<”)<0.
(l)若在绝热恒容密闭容器中,通入一定量的SO2和O2,一定条件下反应,请在如下坐标中画出从开始经一段时间正反应速率[v(正)]随时间(t)的变化曲线图:

(2)若在相同条件下,分别投2molSO2(g)和1molO2(g) 于如下三容器中:
则三容器中反应分别平衡时K的大小关系是KA<KB=KC;SO2的平衡转化率的大小关系是αA<αB<αC.
I.“保险粉”(Na2S2O4)易溶于水、难溶于乙醇,具有极强的还原性,在空气中易被氧化,在碱性介质中稳定.它的制备工艺流程如图所示,请按要求回答下列问题.

(1)“反应”在70℃条件下进行,写出发生反应的离子方程式:HCOO-+OH-+2SO2=S2O42-+CO2+H2O.
(2)在包装保存“保险粉”时加入少量的Na2CO3固体,目的是Na2CO3为碱性物质,提高“保险粉”的稳定性.
(3)现将10mL 0.050mol/L Na2S2O4溶液在空气中放置,其溶液的pH与时间(t)的关系如图所示:(忽略溶液体积的变化).

①t1~t2段溶液中S元素的化合价为+4.
②t3时刻后溶液的pH为1.
Ⅱ.由工业制硫酸反应之一:2SO2(g)+O2(g)$?_{加热}^{催化剂}$2SO3(g),推测此反应的△S(填“>”或“<”)<0,△H(填“>”或“<”)<0.
(l)若在绝热恒容密闭容器中,通入一定量的SO2和O2,一定条件下反应,请在如下坐标中画出从开始经一段时间正反应速率[v(正)]随时间(t)的变化曲线图:


(2)若在相同条件下,分别投2molSO2(g)和1molO2(g) 于如下三容器中:
| 绝热恒容(2L ) 密闭容器A | 恒温(T℃)恒容(2L) 密闭容器B | 恒温(T℃)恒压 密闭容器C | |
| 平衡常数K | KA | KB | KC |
| SO2的平衡转化率 | αA | αB | αC |
2.已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料.下列说法正确的是( )
| A. | 元素B的化合物可以用来做焰火材料 | |
| B. | 化合物AE与CE含有相同类型的化学键 | |
| C. | 工业上常用电解法制备元素C、D、E的单质 | |
| D. | 元素B、D的最高价氧化物对应的水化物之间可能发生反应 |
19.对如图两种化合物的结构或性质描述错误的是( )
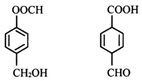

| A. | 均可发生取代、加成反应 | |
| B. | 均能使酸性高锰酸钾溶液褪色 | |
| C. | 分子中共平面的碳原子数相同 | |
| D. | 互为同分异构体,可用NaHCO3溶液鉴别 |
20.利用实验器材(规格和数量不限),能够完成相应实验的一项是( )
| 选项 | 实验器材(省略夹持装置) | 相应实验 |
| A | 量筒、温度计、烧杯、碎纸条、盖板 | 中和热的测定 |
| B | 烧杯、分液漏斗 | 用饱和Na2CO3溶液除去乙酸乙酯中的乙酸和乙醇 |
| C | 量筒、玻璃捧、烧杯、100mL容量瓶 | 用浓盐酸配制100mL 0.1mol•L-1的稀盐酸溶液 |
| D | 烧杯、酸式滴定管、碱式滴定管 | 用出H2SO4标准液滴定未知浓度的NaOH溶液 |
| A. | A | B. | B | C. | C | D. | D |