题目内容
3.“凡酸坏之酒,皆可蒸烧”,“以烧酒复烧二次…,价值数倍也”,这里用到的分离方法为( )| A. | 蒸馏 | B. | 升华 | C. | 萃取 | D. | 蒸发 |
分析 烧酒的制造工艺利用蒸馏的方法,可用于分离沸点不同的液体混合物,以此解答.
解答 解:酸坏之酒中含有乙酸,乙酸和乙醇的沸点不同,用蒸烧的方法分离,故为蒸馏操作.
故选A.
点评 本题考查混合物的分离提纯,为高频考点,把握物质的性质及性质差异为解答的关键,侧重化学与生后的考查,有利于培养学生良好的科学素养,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.如图是元素周期表的一部分
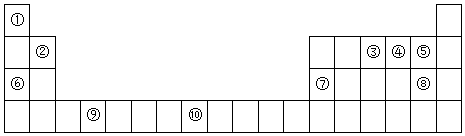
(1)元素⑩原子结构示意图为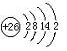 .
.
(2)元素 ③④⑤的电负性由大到小的顺序为F>O>N(填化学用语,下同),其简单离子半径由大到小的顺序为N3->O2->F-.⑤与⑧气态氢化物中稳定性较强的是HF.
(3)某些不同族元素的性质也有一定的相似性,如上表中元素⑦与元素②的单质及其化合物有相似的性质.写出元素②的最高价氧化物与NaOH溶液反应的离子方程式2OH-+BeO=BeO22-+H2O
(4)根据下列五种元素的第一至第四电离能数据(单位:KJ•mol-1),回答下面各题:
①在周期表中,最可能处于同一主族的是R和U.(填元素代号)
②T元素最可能是p(填“s”、“p”、“d”、“ds”等)区元素;若T为第二周期元素,Z是第三周期元素中原子半径最小的主族元素,则T、Z形成的化合物分子键角为120°.
(5)金刚砂(SiC)的结构与金刚石相似,硬度与金刚石相当,则金刚砂的晶胞中含有4个硅原子,4个碳原子,其中硅原子的杂化方式为sp3.

(1)元素⑩原子结构示意图为
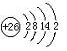 .
.(2)元素 ③④⑤的电负性由大到小的顺序为F>O>N(填化学用语,下同),其简单离子半径由大到小的顺序为N3->O2->F-.⑤与⑧气态氢化物中稳定性较强的是HF.
(3)某些不同族元素的性质也有一定的相似性,如上表中元素⑦与元素②的单质及其化合物有相似的性质.写出元素②的最高价氧化物与NaOH溶液反应的离子方程式2OH-+BeO=BeO22-+H2O
(4)根据下列五种元素的第一至第四电离能数据(单位:KJ•mol-1),回答下面各题:
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
②T元素最可能是p(填“s”、“p”、“d”、“ds”等)区元素;若T为第二周期元素,Z是第三周期元素中原子半径最小的主族元素,则T、Z形成的化合物分子键角为120°.
(5)金刚砂(SiC)的结构与金刚石相似,硬度与金刚石相当,则金刚砂的晶胞中含有4个硅原子,4个碳原子,其中硅原子的杂化方式为sp3.
14.下列事实中,能说明HNO2是弱电解质的是( )
| A. | HNO2溶液用水稀释后,H+浓度下降 | |
| B. | HNO2溶液的导电性比盐酸弱 | |
| C. | HNO2溶液不与氯化钠反应 | |
| D. | 0.lmol•L-1的HNO2溶液的c(H+)=l0-2mol/L |
11.下列化学用语正确的是( )
| A. | NaCl的电子式: | B. | 硫离子的结构示意图: | ||
| C. | 氮气的结构式::N≡N: | D. | 次氯酸的电子式:H:Cl:O: |
18.实验室用30%左右的H2SO4溶液(约3.7mol/L)与锌粒反应制取氢气.下列措施能加快反应速率的是( )
| A. | 适当降低温度 | B. | 将锌粒改为铜粉 | ||
| C. | 将所用硫酸改为98.3%浓硫酸 | D. | 滴加少量CuSO4溶液 |
8.利用如图装置模拟铁的电化学保护.下列说法正确的是( )


| A. | 若X为锌棒,开关K置于M处,为外加电流阴极保护法 | |
| B. | 若X为碳棒,开关K置于N处,为牺牲阳极阴极保护法 | |
| C. | 若X为锌棒,开关K置于M处,Zn极发生:Zn-2e-→Zn2+ | |
| D. | 若X为碳棒,开关K置于N处,X极发生还原反应 |
15.几种短周期元素的原子半径及主要化合价如表:
下列叙述正确的是( )
| 元素代号 | X | Y | Z | W |
| 原子半径/nm | 0.160 | 0.143 | 0.070 | 0.066 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
| A. | 元素的金属性:X<Y | |
| B. | 原子Z的价电子数为5 | |
| C. | 元素的简单离子半径:r(X2+)>r(W2-) | |
| D. | 元素Y的最高价氧化物对应的水化物能溶于氨水 |
7.有A、B、C、D、E五种原子序数小于18的元素,其特征信息如下表:
请回答下列问题:
(1)A、B、C三种元素形成的化合物含有的化学键类型是离子键、(极性)共价键.
(2)由A、B、C元素中两两组合形成的化合物相互反应生成单质的化学方程式是2Na2O2+2H2O=4NaOH+O2↑.
(3)D单质与A、E形成的化合物的水溶液反应的离子方程式是2Al+6H+=2Al3++3H2↑.
(4)写出实验室制取单质E的化学方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(5)C和D两元素形成的单质活泼性较强的是(写元素符号)Na,你的判断依据是Na可与冷水剧烈反应,Al不与水反应.
| 元素编号 | 特征信息 |
| A | 有一种原子内只有质子,没有中子 |
| B | L层电子数是K层的3倍 |
| C | 其阳离子与B的阴离子具有相同的电子层结构,且核电荷数与B相差3 |
| D | 最外层电子数等于电子层数,且是地壳中含量较多的元素之一 |
| E | 单质为黄绿色,可用于制造漂白粉 |
(1)A、B、C三种元素形成的化合物含有的化学键类型是离子键、(极性)共价键.
(2)由A、B、C元素中两两组合形成的化合物相互反应生成单质的化学方程式是2Na2O2+2H2O=4NaOH+O2↑.
(3)D单质与A、E形成的化合物的水溶液反应的离子方程式是2Al+6H+=2Al3++3H2↑.
(4)写出实验室制取单质E的化学方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(5)C和D两元素形成的单质活泼性较强的是(写元素符号)Na,你的判断依据是Na可与冷水剧烈反应,Al不与水反应.
8.利用如图所示的装置可将CO2转化为燃料甲醇,下列说法正确的是( )


| A. | b极发生还原反应 | |
| B. | a极的电极反应:CH3OH+H2O-6e-═CO2+6H+ | |
| C. | 总反应方程式为:2CO2+4H2O$\frac{\underline{\;通电\;}}{\;}$2CH3OH+3O2 | |
| D. | 该装置将化学能转变为电能 |