题目内容
5. 常温下,H3PO4与NaOH溶液反应的体系中,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如图所示[已知Ca3(PO4)2难溶于水].下列有关说法不正确的是( )
常温下,H3PO4与NaOH溶液反应的体系中,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如图所示[已知Ca3(PO4)2难溶于水].下列有关说法不正确的是( )| A. | H3PO4的Ka1=10-2.1,HPO42-的水解平衡常数为10-6.8 | |
| B. | pH=13时,溶液中各微粒浓度大小关系为:c(Na+)>c(HPO42-)>c(PO43-)>c(OH-)>c(H+) | |
| C. | Na2HPO4 溶液显碱性,若向溶液中加入足量的CaCl2 溶液,溶液则显酸性 | |
| D. | 为获得尽可能纯的NaH2PO4,pH应控制在4~5.5左右 |
分析 A.根据电离方程式HPO42-?PO43-+H+,结合各物质的浓度计算,水解常数可以利用离子积常数、电离平衡常数计算得到;
B.由图象可知,在pH=13时,c(HPO42-)<c(PO43-);
C.Na2HPO4溶液显碱性,若向溶液中加入足量的CaCl2溶液,生成Ca3(PO4)2沉淀,促进HPO42-的电离;
D.要获得尽可能纯的NaH2PO4,pH应控制在4~5.5之间;
解答 解:由图象可知横坐标每一小格代表0.5个pH单位,则
A.电离方程式为,H2PO4-?HPO42-+H+,则H3PO4的Ka2=$\frac{1{0}^{-7.2}×0.5}{0.5}$=10-7.2,电离方程式为,HPO42-?PO43-+H+,H3PO4的Ka3=$\frac{1{0}^{-12.2}×0.5}{0.5}$=10-12.2,HPO42-的水解平衡常数=$\frac{c(O{H}^{-})c({H}_{2}P{{O}_{4}}^{-})}{c(HP{{O}_{4}}^{2-})}$×$\frac{c({H}^{+})}{c({H}^{+})}$=$\frac{Kw}{K{a}_{2}}$=$\frac{1{0}^{-14}}{1{0}^{-7.2}}$=10-6.8,故A正确;
B.由图象可知,pH=12.25时,c(HPO42-)=c(PO43-),在pH=13时,c(HPO42-)<c(PO43-),故B错误;
C.Na2HPO4溶液显碱性,若向溶液中加入足量的CaCl2溶液,生成Ca3(PO4)2沉淀,促进HPO42-的电离,溶液则显酸性,故C正确;
D.由图象可知,要获得尽可能纯的NaH2PO4,pH应控制在4~5.5之间,故D正确;
故选B.
点评 本题考查酸碱混合的定性判断和计算,侧重于学生的分析能力和计算能力的考查,为高考常见题型和高频考点,注意把握图象所给信息,为解答该题的关键,难度中等.

| A. | 1s22s22P6 | B. | 1s22s22P33s1 | C. | 1s22s22P63s2 | D. | 1s22s22P63s23P6 |
| A. | H2SO4(浓) | B. | O3 | C. | Ca(ClO)2 | D. | SO2 |
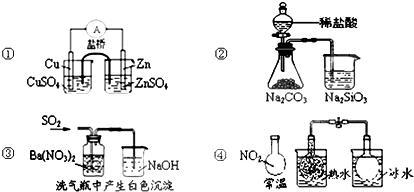
| A. | 图①能组成Zn、Cu原电池 | B. | 图②能证明非金属性Cl>C>Si | ||
| C. | 图③白色沉淀为BaSO3 | D. | 图④说明反应2NO2?N2O4(无色)△H>0 |
I.如图1,用浓HNO3,和过量的废铜屑充分反应制硝酸铜溶液.
(1)写出铜与浓硝酸反应的离子方程式Cu+4H++2NO3-=Cu2++2NO2↑+2H2O.
(2)①装置中NaOH溶液的作用是吸收氮氧化物,防止污染空气.
②欲从反应后的溶液中得到硝酸铜晶体,实验操作步骤是蒸发浓缩、冷却结晶、过滤.
③你认为此装置是否合理,并说明原因不合理,密闭体系中立即产生大量气体,会有安全隐患;或者合理,慢慢挤压,胶头滴管控制反应速率,使NaOH溶液及时吸收NO2.
如果不合理,同时在原装置上改进;如果合理,只需说明原因.
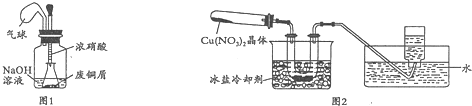
Ⅱ.为了探究Cu(NO3)2的热稳定性,探究小组按图2装置进行实验.(图中铁架台、铁夹和加热仪器均略去)
【实验装置】
【实验操作及现象】往试管中放入研细的无水Cu(NO3)2晶体并加热,观察到试管中有红棕色气体生成,最终残留黑色粉末;用U型管除去红棕色气体,在集气瓶中收集到无色气体.
【解释与结论】
(3)①红棕色气体是NO2.
②根据现象判断Cu(NO3)2在加热条件下可以分解,其化学反应方程式为2Cu(NO3)2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+4NO2↑+O2↑.
Ⅲ.利用Cu(NO3)2制备浅绿色的碱式碳酸铜[CuCO3•Cu(OH)2].
向大试管中加入一定量的碳酸钠溶液和硝酸铜溶液,水浴加热,用0.4mol•L-1的NaOH溶液调节pH至8.5,振荡、静置、过滤、洗涤、干燥,得到样品.
【实验数据】反应温度对样品的影响
| 实验序号 | 1 | 2 | 3 | 4 |
| 温度/℃ | 35 | 50 | 70 | 95 |
| 样品颜色 | 深蓝色 | 深蓝色 | 浅绿色 | 暗蓝色 |
| 样品中碱式碳酸铜的质量分数/% | 90.9 | 92.7 | x | 92.0 |
(5)95℃时,样品颜色发暗的原因:含有黑色的氧化铜.
(6)70℃时,实验得到2.38g样品,取此样品加热至分解完全(杂质不分解),得到1.76g固体,此样品中碱式碳酸铜的质量分数是93.3%.
| A. | 医疗上常用75%的酒精杀菌消毒 | |
| B. | 由于分子间氢键的存在,NH3易液化,H2O常温下呈液态 | |
| C. | 雾霾公益调查纪录片《穹顶之下》的发布引起了人们的关注,雾霾属于胶体 | |
| D. | 氢气是理想的绿色能源,贮氢合金的发现和应用解决了氢气贮存运输的难题,贮氢金属与氢气发生化学反应,形成氢化物,达到贮存氢气的目的 |
