题目内容
15.下列电子排布式中,原子处于激发态的是( )| A. | 1s22s22P6 | B. | 1s22s22P33s1 | C. | 1s22s22P63s2 | D. | 1s22s22P63s23P6 |
分析 原子的核外电子排布符合基态原子核外电子填充的能级顺序和能量最低原理、泡利不相容原理及洪特规则,原子处于基态,否则为激发态,以此进行判断.
解答 解:基态原子的电子排布式符合能量最低原理,A、C、D项均为基态;B项1s22s23s1为激发态,根据能量最低原理,其基态应为1s22s22p1.
故选B.
点评 本题考查原子核外电子的排布,侧重于激发态的判断,可根据能量最低原理进行判断,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.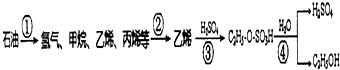 以石油为原料制备乙醇的转化流程图如下所示:跟如图流程图相关的说法中正确的是( )
以石油为原料制备乙醇的转化流程图如下所示:跟如图流程图相关的说法中正确的是( )
 以石油为原料制备乙醇的转化流程图如下所示:跟如图流程图相关的说法中正确的是( )
以石油为原料制备乙醇的转化流程图如下所示:跟如图流程图相关的说法中正确的是( )| A. | 流程图①中产物均为烃类,产物均为可燃性气体 | |
| B. | 流程图①中需减压分馏,②中需分馏分离出乙烯 | |
| C. | 流程图③中发生加成反应,④中发生取代反应 | |
| D. | 乙醇、硫酸都能够使蛋白质变性,都可用于皮肤消毒 |
3.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,11.2LN0与02的混合气体含有的分子数为0.5NA | |
| B. | 常温下,1mol铁与足量的硫反应,转移电子为2NA | |
| C. | 常温常压下,22gC3H8中含有的共价键数8NA | |
| D. | 0.1mol/L的CH3COONa溶液20mL,含有CH3COO-数目为0.002NA |
10.C、Cl、S、Ti、Fe、Cr元素的单质和化合物的应用研究是目前科学研究的前沿之一,请回答下列问题.
(1)Ti(BH4)2是一种重要的储氢材料.在基态Ti2+中,电子占据的最高能层符号为M,该能层具有的原子轨道数为9.
(2)CH4中共用电子对偏向C,SiH4中硅元素为+4价,则C、Si、H的电负性由大到小的顺序为C>H>Si.
(3)①甲醇(CH3OH)分子内的O-C-H键角小于(填“大于”、“等于”或“小于”)甲醛(H2C═O)分子内的O-C-H键角.
②ClO2-中心氯原子的杂化轨道类型为,写出CN-的等电子体的分子式N2(写出1个).
③石墨烯的应用为电子行业的发展带来了重大的突破,其结构可以看作是单层的石墨,其中碳原子的杂化方式为sp2;
(4)根据表中的数据回答问题
①若只考虑相对分子质量,甲醇的沸点应低于-78.2,甲醇沸点高的原因是甲醇分子之间可以形成氢键
②1mol丙烯中所含σ键和π键数目之比为8:1
③一氟甲烷的空间构型为四面体型.
(1)Ti(BH4)2是一种重要的储氢材料.在基态Ti2+中,电子占据的最高能层符号为M,该能层具有的原子轨道数为9.
(2)CH4中共用电子对偏向C,SiH4中硅元素为+4价,则C、Si、H的电负性由大到小的顺序为C>H>Si.
(3)①甲醇(CH3OH)分子内的O-C-H键角小于(填“大于”、“等于”或“小于”)甲醛(H2C═O)分子内的O-C-H键角.
②ClO2-中心氯原子的杂化轨道类型为,写出CN-的等电子体的分子式N2(写出1个).
③石墨烯的应用为电子行业的发展带来了重大的突破,其结构可以看作是单层的石墨,其中碳原子的杂化方式为sp2;
(4)根据表中的数据回答问题
| 有机物 | 甲醇(CH3OH) | 丙烯(CH3CH=CH2) | 一氟甲烷(CH3F) |
| 相对分子质量 | 32 | 42 | 34 |
| 沸点/℃ | 64.7 | -47.4 | -78.2 |
②1mol丙烯中所含σ键和π键数目之比为8:1
③一氟甲烷的空间构型为四面体型.
20.J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素.
(1)M的离子结构示意图为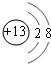 ;元素T在周期表中位于第ⅦA族.
;元素T在周期表中位于第ⅦA族.
(2)J和氢组成的化合物分子有6个原子,其结构简式为CH2=CH2.
(3)L的最简单气态氢化物甲的水溶液显碱性.
①在微电子工业中,甲的水溶液可作刻蚀剂H2O2 的清除剂,所发生反应的产物不污染环境,其化学方程式为2NH3.H2O+3H2O2═N2↑+8H2O.
②一定条件下,甲在固定体积的密闭容器中发生分解反应(△H>0)并达平衡后,仅改变下表中反应条件x,该平衡体系中随x递增y递减的是bc(选填序号).
(4)M和T形成的化合物在潮湿的空气中冒白色烟雾,反应的化学方程式为:AlCl3+3H2O?Al(OH)3+3HCl↑.
(5)用等式表示R的氢化物与NaOH溶液反应后生成正盐的溶液中所有离子浓度之间的关系c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-).
| J | ||||
| R |
 ;元素T在周期表中位于第ⅦA族.
;元素T在周期表中位于第ⅦA族.(2)J和氢组成的化合物分子有6个原子,其结构简式为CH2=CH2.
(3)L的最简单气态氢化物甲的水溶液显碱性.
①在微电子工业中,甲的水溶液可作刻蚀剂H2O2 的清除剂,所发生反应的产物不污染环境,其化学方程式为2NH3.H2O+3H2O2═N2↑+8H2O.
②一定条件下,甲在固定体积的密闭容器中发生分解反应(△H>0)并达平衡后,仅改变下表中反应条件x,该平衡体系中随x递增y递减的是bc(选填序号).
| 选项 | a | b | c | d |
| x | 温度 | 温度 | 加入H2的物质的量 | 加入甲的物质的量 |
| y | 平衡常数K | 甲的物质的量 | 甲的转化率 | 生成物物质的量总和 |
(5)用等式表示R的氢化物与NaOH溶液反应后生成正盐的溶液中所有离子浓度之间的关系c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-).
7.某无色溶液中能大量共存的离子组是( )
| A. | Na+、OH-、Cu2+ | B. | H+、SO42-、HCO3- | C. | SO42-、Cl-、Na+ | D. | Ca2+、Cl-、CO32- |
4.通过溶解、过滤、蒸发等操作,可将下列各组混合物分离的是( )
| A. | 硝酸钠 氢氧化钠 | B. | 氧化铜 二氧化锰 | ||
| C. | 氯化钾 二氧化锰 | D. | 硫酸铜 氢氧化钙 |
5. 常温下,H3PO4与NaOH溶液反应的体系中,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如图所示[已知Ca3(PO4)2难溶于水].下列有关说法不正确的是( )
常温下,H3PO4与NaOH溶液反应的体系中,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如图所示[已知Ca3(PO4)2难溶于水].下列有关说法不正确的是( )
 常温下,H3PO4与NaOH溶液反应的体系中,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如图所示[已知Ca3(PO4)2难溶于水].下列有关说法不正确的是( )
常温下,H3PO4与NaOH溶液反应的体系中,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如图所示[已知Ca3(PO4)2难溶于水].下列有关说法不正确的是( )| A. | H3PO4的Ka1=10-2.1,HPO42-的水解平衡常数为10-6.8 | |
| B. | pH=13时,溶液中各微粒浓度大小关系为:c(Na+)>c(HPO42-)>c(PO43-)>c(OH-)>c(H+) | |
| C. | Na2HPO4 溶液显碱性,若向溶液中加入足量的CaCl2 溶液,溶液则显酸性 | |
| D. | 为获得尽可能纯的NaH2PO4,pH应控制在4~5.5左右 |
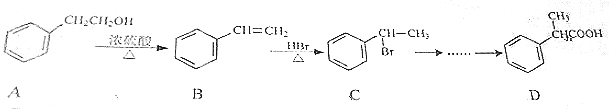
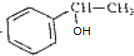
 .
.