题目内容
10.请回答:(1)N2H4的结构式

(2)在制作印刷电路板的过程中常利用铜与氯化铁溶液反应,写出该反应的化学方程式2FeCl3+Cu═2FeCl2+CuCl2.
(3)锅炉水垢中的硫酸钙可用碳酸钠饱和溶液处理,使之转化为碳酸钙,再用酸除去.
写出转化反应的离子方程式:CaSO4+CO32-═CaCO3+SO42-.
(4)乙醇与重铬酸钾酸性溶液反应生成Cr3+,溶液的颜色由橙变绿.据此原理可检查驾驶员是否酒后开车,请完成并配平以下方程式:
2Cr2O72-+3CH3CH2OH+=4Cr3++3CH3COOH+.
分析 (1)肼是共价化合物氮原子和氢原子形成共价键,氮原子和氮原子间也形成共价键;
(2)铜与氯化铁溶液反应生成FeCl2和CuCl2;
(3)类型相同,溶度积小的溶解度小,溶解度大的沉淀可转化为溶解度小的沉淀;
(4)反应中Cr元素的化合价降低,乙醇中C元素的化合价升高,根据元素化合价的变化以及得失电子守恒配平.
解答 解:(1)联氨是共价化合物氮原子和氢原子形成共价键,氮原子和氮原子间也形成共价键,结构式为: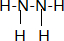 ,
,
故答案为: ;
;
(2)氯化铁具有氧化性,铜具有还原性,两者发生氧化还原反应,生成氯化亚铁和氯化铜,化学反应为:2FeCl 3+Cu═2FeCl 2+CuCl2,
故答案为:2FeCl3+Cu═2FeCl2+CuCl2;
(3)CaCO3与CaSO4类型相同,碳酸钙的溶度积小,所以溶解度的大小关系为CaCO3<CaSO4,硫酸钙可用碳酸钠饱和溶液处理,使之转化为碳酸钙,离子反应为:CaSO4+CO32-═CaCO3+SO42-,
故答案为:CaSO4+CO32-═CaCO3+SO42-;
(4)Cr2O72-具有强氧化性,遇到有机物(如酒精)时,乙醇被氧化成乙酸,碳的平均化合价从-2价升高到0,1个乙醇化合价变化4,Cr2O72-被还原成绿色的硫酸铬[Cr2(SO4)3],铬的化合价从+6价降低到+3价,1个Cr2O72-化合价变化6,两者的最小公倍数是12,根据得失电子和电荷守恒配平得2Cr2O72-+3C2H5OH+16H+═4Cr3++3CH3COOH+11H2O,
故答案为:2;3;16H+;4;3;11H2O.
点评 本题考查常用化学用语,掌握结构式的书写、氧化还原反应配平是解答关键,题目难度中等.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案
相关题目
20.J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素.
(1)M的离子结构示意图为 ;元素T在周期表中位于第ⅦA族.
;元素T在周期表中位于第ⅦA族.
(2)J和氢组成的化合物分子有6个原子,其结构简式为CH2=CH2.
(3)L的最简单气态氢化物甲的水溶液显碱性.
①在微电子工业中,甲的水溶液可作刻蚀剂H2O2 的清除剂,所发生反应的产物不污染环境,其化学方程式为2NH3.H2O+3H2O2═N2↑+8H2O.
②一定条件下,甲在固定体积的密闭容器中发生分解反应(△H>0)并达平衡后,仅改变下表中反应条件x,该平衡体系中随x递增y递减的是bc(选填序号).
(4)M和T形成的化合物在潮湿的空气中冒白色烟雾,反应的化学方程式为:AlCl3+3H2O?Al(OH)3+3HCl↑.
(5)用等式表示R的氢化物与NaOH溶液反应后生成正盐的溶液中所有离子浓度之间的关系c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-).
| J | ||||
| R |
 ;元素T在周期表中位于第ⅦA族.
;元素T在周期表中位于第ⅦA族.(2)J和氢组成的化合物分子有6个原子,其结构简式为CH2=CH2.
(3)L的最简单气态氢化物甲的水溶液显碱性.
①在微电子工业中,甲的水溶液可作刻蚀剂H2O2 的清除剂,所发生反应的产物不污染环境,其化学方程式为2NH3.H2O+3H2O2═N2↑+8H2O.
②一定条件下,甲在固定体积的密闭容器中发生分解反应(△H>0)并达平衡后,仅改变下表中反应条件x,该平衡体系中随x递增y递减的是bc(选填序号).
| 选项 | a | b | c | d |
| x | 温度 | 温度 | 加入H2的物质的量 | 加入甲的物质的量 |
| y | 平衡常数K | 甲的物质的量 | 甲的转化率 | 生成物物质的量总和 |
(5)用等式表示R的氢化物与NaOH溶液反应后生成正盐的溶液中所有离子浓度之间的关系c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-).
18.下列说法不正确的是( )
| A. | 硝化甘油在体内能够分解出NO,少量的NO会促进血管扩张,防止血管栓塞,因此,被广泛用于治疗心绞痛 | |
| B. | TNT爆炸的方程式为:2C7H5N3O6(s)→6CO2(g)+5H2(g)+3N2(g)+8C(s),因而爆炸过程会产生大量的黑烟 | |
| C. | 为迎接G20峰会,全市努力植树造林,节能减排防治PM2.5,PM2.5是指大气中直径小于或等于2.5纳米的可吸入颗粒物 | |
| D. | 用中子轰击Hg核能发生下面的反应:80196Hg+01n→80197Hg→79197Au+e+制得金核,这个过程不属于化学变化 |
5. 常温下,H3PO4与NaOH溶液反应的体系中,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如图所示[已知Ca3(PO4)2难溶于水].下列有关说法不正确的是( )
常温下,H3PO4与NaOH溶液反应的体系中,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如图所示[已知Ca3(PO4)2难溶于水].下列有关说法不正确的是( )
 常温下,H3PO4与NaOH溶液反应的体系中,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如图所示[已知Ca3(PO4)2难溶于水].下列有关说法不正确的是( )
常温下,H3PO4与NaOH溶液反应的体系中,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如图所示[已知Ca3(PO4)2难溶于水].下列有关说法不正确的是( )| A. | H3PO4的Ka1=10-2.1,HPO42-的水解平衡常数为10-6.8 | |
| B. | pH=13时,溶液中各微粒浓度大小关系为:c(Na+)>c(HPO42-)>c(PO43-)>c(OH-)>c(H+) | |
| C. | Na2HPO4 溶液显碱性,若向溶液中加入足量的CaCl2 溶液,溶液则显酸性 | |
| D. | 为获得尽可能纯的NaH2PO4,pH应控制在4~5.5左右 |
15.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,5.6L NO和5.6L O2混合后的分子总数为0.5NA | |
| B. | 25g 质量分数为68%的H2O2水溶液中含氧原子数目为NA | |
| C. | 高温下,16.8g Fe 与足量水蒸气完全反应失去0.8NA个电子 | |
| D. | 1mol CH5+中含有的电子数目为11NA |
2.下列说法正确的是( )
| A. | 酸碱中和滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液,导致实验结果偏高 | |
| B. | 某溶液中滴加HNO3无明显现象,再滴加Ba(NO3)2溶液出现白色沉淀,说明原溶液中含有SO42- | |
| C. | 制备乙酸乙酯的实验中,用饱和食盐水除杂 | |
| D. | 在蒸发皿中加热蒸干AlCl3可以得到该物质的固体 |
 .
.