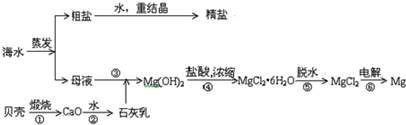
题目内容
13.关于下列图示的说法中正确的是( )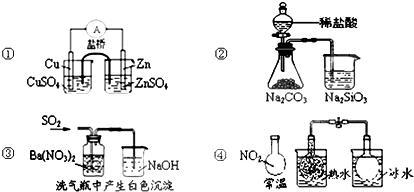
| A. | 图①能组成Zn、Cu原电池 | B. | 图②能证明非金属性Cl>C>Si | ||
| C. | 图③白色沉淀为BaSO3 | D. | 图④说明反应2NO2?N2O4(无色)△H>0 |
分析 A.Zn为负极失去电子,Cu为正极,利用盐桥可构成原电池;
B.盐酸易挥发,HCl与硅酸钠溶液反应;
C.二氧化硫与硝酸钡发生氧化还原反应生成BaSO4;
D.2NO2(g)?N2O4(g)△H<0.
解答 解:A.Zn为负极失去电子,Cu为正极,利用盐桥可构成原电池,则图①能组成Zn、Cu原电池,故A正确;
B.盐酸易挥发,HCl与硅酸钠溶液反应,则不能比较C、Si的非金属性,故B错误;
C.二氧化硫与硝酸钡发生氧化还原反应生成BaSO4,不生成BaSO3,故C错误;
D.由图可知,热水中颜色深,则2NO2(g)?N2O4(g)△H<0,故D错误;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应、实验装置的作用、实验技能等为解答的关键,侧重分析与实验能力的考查,注意元素化合物、反应原理与实验的结合,题目难度不大.

练习册系列答案
相关题目
3.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,11.2LN0与02的混合气体含有的分子数为0.5NA | |
| B. | 常温下,1mol铁与足量的硫反应,转移电子为2NA | |
| C. | 常温常压下,22gC3H8中含有的共价键数8NA | |
| D. | 0.1mol/L的CH3COONa溶液20mL,含有CH3COO-数目为0.002NA |
4.通过溶解、过滤、蒸发等操作,可将下列各组混合物分离的是( )
| A. | 硝酸钠 氢氧化钠 | B. | 氧化铜 二氧化锰 | ||
| C. | 氯化钾 二氧化锰 | D. | 硫酸铜 氢氧化钙 |
8.I.从海水中可以提取氯、溴、碘等卤族元素.

(1)碘元素在周期表中的位置为第五周期,第ⅤⅡA族.
(2)已知:X2(g)+H2(g)=2HX(g)(X2表示C12、Br2和12).如图1表示平定
衡常数K与温度t的关系.
①△H表示X2与H2反应的焓变,△H<O.(填“>“、“<’’或‘‘=’’)
②曲线a表示的是12(填“C12”、“Br2“或“12’’)与H2反应时K与t
的关系.
II.C12是一种重要的化工原料.
(3)液氯储存区贴有的说明卡如表(部分):
①用离子方程式表示“泄漏处理’’中NaHS03溶液的作用HSO3-+Cl2+H2O═SO42-+2Cl-+3H+.
②若液氯泄漏后遇到苯,在钢瓶表面氯与苯的反应明显加快,原因是铁与氯气反应生成的氯化铁,对氯与苯的反应有催化作用.
③氯气含量检测仪工作原理示意图如图2:C12在Pt电极放电的电极反应式是Cl2+2e-+2Ag+═2AgCl.
(4)质量标准要求液氯含水量(以1g氯气含水的质量计)<0.4mg,含水量超标会严重腐蚀钢瓶.液氯含水量的测定装置如图3所示:(已知:P2O5+3H2O=2H3PO4;C12与P2O5不反应.)检测液氯的含水量,根据如图,需要测定的数据是分别测定通液氯样品前后a、c的质量.

(1)碘元素在周期表中的位置为第五周期,第ⅤⅡA族.
(2)已知:X2(g)+H2(g)=2HX(g)(X2表示C12、Br2和12).如图1表示平定
衡常数K与温度t的关系.
①△H表示X2与H2反应的焓变,△H<O.(填“>“、“<’’或‘‘=’’)
②曲线a表示的是12(填“C12”、“Br2“或“12’’)与H2反应时K与t
的关系.
II.C12是一种重要的化工原料.
(3)液氯储存区贴有的说明卡如表(部分):
| 危险性 |  |
| 储运要求 | 远离金属粉末、氨、烃类、醇更物质;设置氯气检测仪 |
| 泄漏处理 | NaOH、NaHSO3溶液吸收 |
| 包装 | 钢瓶 |
②若液氯泄漏后遇到苯,在钢瓶表面氯与苯的反应明显加快,原因是铁与氯气反应生成的氯化铁,对氯与苯的反应有催化作用.
③氯气含量检测仪工作原理示意图如图2:C12在Pt电极放电的电极反应式是Cl2+2e-+2Ag+═2AgCl.
(4)质量标准要求液氯含水量(以1g氯气含水的质量计)<0.4mg,含水量超标会严重腐蚀钢瓶.液氯含水量的测定装置如图3所示:(已知:P2O5+3H2O=2H3PO4;C12与P2O5不反应.)检测液氯的含水量,根据如图,需要测定的数据是分别测定通液氯样品前后a、c的质量.
18.下列说法不正确的是( )
| A. | 硝化甘油在体内能够分解出NO,少量的NO会促进血管扩张,防止血管栓塞,因此,被广泛用于治疗心绞痛 | |
| B. | TNT爆炸的方程式为:2C7H5N3O6(s)→6CO2(g)+5H2(g)+3N2(g)+8C(s),因而爆炸过程会产生大量的黑烟 | |
| C. | 为迎接G20峰会,全市努力植树造林,节能减排防治PM2.5,PM2.5是指大气中直径小于或等于2.5纳米的可吸入颗粒物 | |
| D. | 用中子轰击Hg核能发生下面的反应:80196Hg+01n→80197Hg→79197Au+e+制得金核,这个过程不属于化学变化 |
5. 常温下,H3PO4与NaOH溶液反应的体系中,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如图所示[已知Ca3(PO4)2难溶于水].下列有关说法不正确的是( )
常温下,H3PO4与NaOH溶液反应的体系中,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如图所示[已知Ca3(PO4)2难溶于水].下列有关说法不正确的是( )
 常温下,H3PO4与NaOH溶液反应的体系中,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如图所示[已知Ca3(PO4)2难溶于水].下列有关说法不正确的是( )
常温下,H3PO4与NaOH溶液反应的体系中,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如图所示[已知Ca3(PO4)2难溶于水].下列有关说法不正确的是( )| A. | H3PO4的Ka1=10-2.1,HPO42-的水解平衡常数为10-6.8 | |
| B. | pH=13时,溶液中各微粒浓度大小关系为:c(Na+)>c(HPO42-)>c(PO43-)>c(OH-)>c(H+) | |
| C. | Na2HPO4 溶液显碱性,若向溶液中加入足量的CaCl2 溶液,溶液则显酸性 | |
| D. | 为获得尽可能纯的NaH2PO4,pH应控制在4~5.5左右 |
2.下列说法正确的是( )
| A. | 酸碱中和滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液,导致实验结果偏高 | |
| B. | 某溶液中滴加HNO3无明显现象,再滴加Ba(NO3)2溶液出现白色沉淀,说明原溶液中含有SO42- | |
| C. | 制备乙酸乙酯的实验中,用饱和食盐水除杂 | |
| D. | 在蒸发皿中加热蒸干AlCl3可以得到该物质的固体 |
13.若用18O标记的CH3CH218OH与乙酸反应制取乙酸乙酯,则会出现的结果是( )
| A. | 18O 只存在于乙酸乙酯中 | B. | 18O 只存在于水中 | ||
| C. | 18O 只存在于乙醇和乙酸乙酯中 | D. | 18O 只存在于乙醇和水中 |