题目内容
18.下列物质能促进水的电离的是( )| A. | 碳酸钠 | B. | 醋酸 | C. | 乙醇 | D. | 氯化钠 |
分析 水为弱电解质,能够电解出氢离子和氢氧根离子,在溶液中存在电离平衡;加入酸溶液和碱溶液能够抑制水的电离,加入能够水解的盐促进了水的电离,据此进行判断.
解答 解:A、碳酸钠溶液中碳酸根离子水解溶液显碱性,水的电离程度增大,碳酸钠促进了水的电离,故A正确;
B、加入醋酸,溶液中氢离子浓度增大,水的电离平衡向着逆向移动,抑制了水的电离,故B错误;
C、加入乙醇,乙醇为非电解质,对水的电离平衡不产生影响,故C错误;
D、加入氯化钠,钠离子和氯离子都不影响水的电离,故D错误;
故选A.
点评 本题考查了水的电离及其影响因素,题目难度不大,注意掌握水的电离及影响,明确酸碱溶液抑制水的电离,含有弱酸根或者弱碱根离子的盐能够促进水的电离.

练习册系列答案
 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案
相关题目
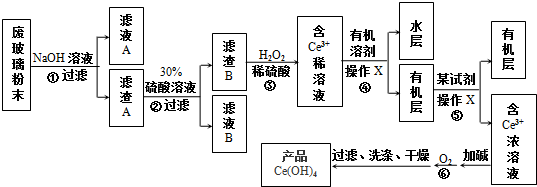
9.结合表回答下列问题:
现有某酸性CuCl2溶液中含有少量的FeCl2,为得到纯净的CuCl2•2H2O晶体,按如图步骤进行提纯:
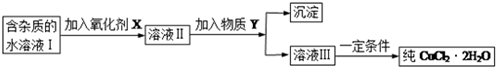
(1)最适合作氧化剂X的是C(填字母),加入X的目的是将Fe2+氧化成Fe3+,便于生成沉淀与Cu2+分离.
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
加入的物质Y是CuO(或Cu(OH)2、CuCO3、Cu2(OH)2CO3)(填化学式),调至溶液pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=4.0×10-8mol/L.过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2•2H2O晶体.
(2)在空气中直接加热CuCl2•2H2O晶体得不到纯的无水CuCl2,由CuCl2•2H2O晶体得到纯的无水CuCl2的合理方法是在HCl气氛中蒸发结晶.
| 物 质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| 溶度积/25℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |

(1)最适合作氧化剂X的是C(填字母),加入X的目的是将Fe2+氧化成Fe3+,便于生成沉淀与Cu2+分离.
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
加入的物质Y是CuO(或Cu(OH)2、CuCO3、Cu2(OH)2CO3)(填化学式),调至溶液pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=4.0×10-8mol/L.过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2•2H2O晶体.
(2)在空气中直接加热CuCl2•2H2O晶体得不到纯的无水CuCl2,由CuCl2•2H2O晶体得到纯的无水CuCl2的合理方法是在HCl气氛中蒸发结晶.
6.下列物质中,不能使品红溶液褪色的是( )
| A. | 次氯酸 | B. | 活性炭 | C. | 二氧化碳 | D. | 二氧化硫 |
13.检验实验室配制的FeCl2溶液是否氧化变质,应选用的最适宜的试剂是( )
| A. | 稀硝酸 | B. | KSCN溶液 | C. | 溴水 | D. | 酸性KMnO4溶液 |
10.下列叙述正确的是( )
| A. | HF、HCl、HBr、HI的熔点沸点依次升高 | |
| B. | 氯的各种含氧酸的酸性由强到弱排列为HClO4<HClO3<HClO2<HClO | |
| C. | 元素的性质呈现周期性变化的根本原因是元素原子的核外电子排布呈周期性变化 | |
| D. | 稀有气体一般难于发生化学反应,是由于其键能大 |
7.铝热反应原理可以应用在生产上,例如焊接钢轨、冶炼难熔金属、制作传统的烟火剂等.某小组同学在研究铝热反应时,进行如下讨论和实验.
(1)关于铝热反应有以下两种认识,其中正确的是b(填字母序号).
a.该反应需在高温下发生,所以是吸热反应
b.因为铝的还原性较强,所以铝能将相对不活泼的金属从其化合物中置换出来
(2)铝和氧化铁反应的化学方程式是2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3.
(3)铝和氧化铁反应所得固体成分的初步确定.
①由上述实验可知:溶液中Fe元素的存在形式有Fe2+、Fe3+.
②i中产生H2的原因是样品中除含Fe外,可能有未反应的Al,为检验样品中是否含Al单质,可选用的试剂是
NaOH溶液,写出该反应的离子方程式2OH-+2Al+2H2O=2AlO2-+3H2↑.
③ii中生成O2的化学方程式是2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑.
(1)关于铝热反应有以下两种认识,其中正确的是b(填字母序号).
a.该反应需在高温下发生,所以是吸热反应
b.因为铝的还原性较强,所以铝能将相对不活泼的金属从其化合物中置换出来
(2)铝和氧化铁反应的化学方程式是2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3.
(3)铝和氧化铁反应所得固体成分的初步确定.
| 实验序号 | 操作现象 |
| i | 取少量固体样品,加入过量稀盐酸,固体溶解,产生气体(经检验为H2),溶液呈浅黄色 |
| ii | 向i所得溶液中加入少量KSCN溶液,溶液呈浅红色,再加入H2O2溶液,产生无色气体(经检验为O2,溶液变为深红色) |
②i中产生H2的原因是样品中除含Fe外,可能有未反应的Al,为检验样品中是否含Al单质,可选用的试剂是
NaOH溶液,写出该反应的离子方程式2OH-+2Al+2H2O=2AlO2-+3H2↑.
③ii中生成O2的化学方程式是2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑.
8.下列反应可用于设计原电池的是( )
| A. | CO2+2H2O→CH4+2O2 | B. | NaOH+HCl=NaCl+H2O | ||
| C. | Cu+2HCl=Cu Cl2+H2↑ | D. | 4Al+3O2+6H2O=4Al(OH)3 |