题目内容
3.平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2等物质).以此粉末为原料回收Ce(OH)4和绿矾的工艺流程如图所示: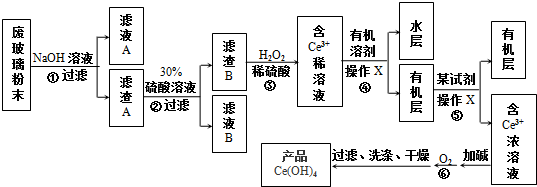
已知:
Ⅰ.酸性条件下,铈在水溶液中有Ce3+、Ce4+两种主要存在形式;
Ⅱ.CeO2不溶于稀硫酸;利用有机溶剂可分离稀土元素如Ce等化合物.
请按要求回答下列问题:
(1)Ce的原子序数为58,它位于元素周期表中第六周期.
(2)步骤 ①、⑥反应的化学方程式分别为2NaOH+SiO2=Na2SiO3+H2O、4Ce(OH)3+O2+2H2O=4Ce(OH)4.
(3)检验滤渣B洗涤干净的方法是取少量最后一次洗涤液于试管中,滴加几滴KSCN溶液,若不出现红色,则已洗净.
(4)步骤 ③的离子方程式为2CeO2+H2O2+6H+=2Ce3++O2↑+4H2O.
(5)操作X名称为萃取分液.
(6)在滤液B中加过量铁粉于50℃水浴中加热充分反应后趁热过滤,滤液移至试管中,用橡胶塞塞紧试管口,静置、冷却一段时间后收集得产品绿矾.
步骤 ②中的硫酸溶液过稀会导致反应速率慢、不利于晶体析出;溶液趁热过滤的原因是减少FeSO4的损失;塞紧试管口的目的是防止空气进入试管将Fe2+氧化为Fe3+;静置冷却一段时间后,在试管中观察到的现象是有浅绿色晶体析出.
(7)取2.08g产品Ce(OH)4,加过量稀硫酸溶解后,用0.1000mol/L FeSO4溶液滴定至终点共消耗90.00mL,则产品中Ce(OH)4的质量分数为90%.
分析 以废玻璃粉末(含SiO2、Fe2O3、CeO2等物质)为原料回收Ce(OH)4和绿矾的工艺流程为:第①步反应废玻璃粉末加氢氧化钠溶液后过滤,得到滤渣A的成分是Fe2O3、CeO2,二氧化硅与氢氧化钠反应生成硅酸钠,溶于水;滤渣A(Fe2O3、CeO2)加稀硫酸后过滤得滤液B是硫酸铁溶液,滤渣B的成分是CeO2;第③步反应CeO2与H2O2和稀H2SO4反应生成Ce3+和O2;第④步是用有机溶剂将Ce3+萃取出来,通过分液操作可得有机层含有Ce3+,第⑤步用某试剂进行反应萃取,得浓的Ce3+溶液,第⑥步浓的Ce3+溶液中加碱,再用氧气氧化得Ce(OH)4,据此答题;
解答 解:以废玻璃粉末(含SiO2、Fe2O3、CeO2等物质)为原料回收Ce(OH)4和绿矾的工艺流程为:第①步反应废玻璃粉末加氢氧化钠溶液后过滤,得到滤渣A的成分是Fe2O3、CeO2,二氧化硅与氢氧化钠反应生成硅酸钠,溶于水;滤渣A(Fe2O3、CeO2)加稀硫酸后过滤得滤液B是硫酸铁溶液,滤渣B的成分是CeO2;第③步反应CeO2与H2O2和稀H2SO4反应生成Ce3+和O2;第④步是用有机溶剂将Ce3+萃取出来,通过分液操作可得有机层含有Ce3+,第⑤步用某试剂进行反应萃取,得浓的Ce3+溶液,第⑥步浓的Ce3+溶液中加碱,再用氧气氧化得Ce(OH)4,
(1)Ce的原子序数为58,根据元素周期表可知,它位于元素周期表中第六周期,
故答案为:六;
(2)根据上面的分析可知,步骤 ①反应的化学方程式为2NaOH+SiO2=Na2SiO3+H2O,步骤 ⑥反应的化学方程式为 4Ce(OH)3+O2+2H2O=4Ce(OH)4,
故答案为:2NaOH+SiO2=Na2SiO3+H2O;4Ce(OH)3+O2+2H2O=4Ce(OH)4;
(3)滤渣B的表面有可能的杂质为铁离子,所以检验滤渣B洗涤干净的方法是取少量最后一次洗涤液于试管中,滴加几滴KSCN溶液,若不出现红色,则已洗净,
故答案为:取少量最后一次洗涤液于试管中,滴加几滴KSCN溶液,若不出现红色,则已洗净;
(4)根据上面的分析可知,步骤 ③的离子方程式为2CeO2+H2O2+6H+=2Ce3++O2↑+4H2O,
故答案为:2CeO2+H2O2+6H+=2Ce3++O2↑+4H2O;
(5)根据上面的分析可知,操作X名称为萃取分液,
故答案为:萃取分液;
(6)步骤 ②中的硫酸溶液过稀会导致反应速率慢、不利于晶体析出,在滤液B中加过量铁粉于50℃水浴中加热充分反应后趁热过滤,可以减少FeSO4的损失,亚铁离子易被空气中的氧气氧化,所以实验时要塞紧试管口,静置冷却一段时间后,在试管中观察到的现象是有浅绿色晶体析出,
故答案为:反应速率慢、不利于晶体析出;减少FeSO4的损失;防止空气进入试管将Fe2+氧化为Fe3+;有浅绿色晶体析出;
(7)FeSO4的物质的量为0.1000mol/L×90.00mL×10-3=9.0×10-3mol,根据电子得失守恒有关系式FeSO4~Ce(OH)4,所以取2.08g产品中Ce(OH)4的质量为9.0×10-3mol×208g/mol=1.872g,所以产品中Ce(OH)4的质量分数为$\frac{1.872g}{2.08g}$×100%=90%,
故答案为:90%.
点评 本题以工艺流程为基础,考查化学实验基本操作、元素及化合物知识、化学计算、氧化还原反应等相关知识,题目难度中等,明确实验流程及反应原理为解答关键,试题有利于培养学生的分析、理解能力及化学实验、化学计算能力.

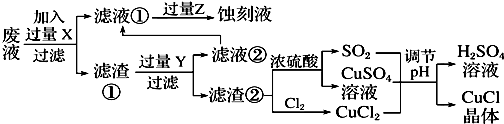
根据以上信息回答下列问题:
(1)写出生产过程中XFe,YHCl.
(2)写出产生CuCl的化学方程式:CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2H2SO4.
(3)在CuCl的生成过程中理论上不需要补充SO2气体,结合化学方程式和必要的文字说明理由:Cu+2 H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O反应中生成的CuSO4和 SO2为1:1,所以理论上不需要补充SO2气体.
(4)在CuCl的生成过程中除环境问题、安全问题外,你认为还应该注意的关键问题是防止CuCl的氧化和见光分解,减少产品CuCl的损失.
(5)实验探究pH对CuCl产率的影响如下表所示:
| pH | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| CuCl产率 | 70 | 90 | 82 | 78 | 75 | 72 | 70 |
(6)氯化亚铜的定量分析:
①称取样品0.25g和10mL过量的FeCl3溶液于250mL锥形瓶中,充分溶解.
②用0.10mol•L-1硫酸铈[Ce(SO4)2]标准溶液滴定.
已知:CuCl+FeCl3═CuCl2+FeCl2、Fe2++Ce4+═Fe3++Ce3+.
三次平行实验结果如下(平行实验结果相差不能超过1%):
| 平行实验次数 | 1 | 2 | 3 |
| 0.25g样品消耗硫酸铈标准溶液的体积(mL) | 24.35 | 24.05 | 23.95 |
| A. | 碳酸钠 | B. | 醋酸 | C. | 乙醇 | D. | 氯化钠 |
| A. | 金属性:Li<Na<K | B. | 沸点:HF<HCl<HBr<HI | ||
| C. | 稳定性:HCl>H2S>PH3 | D. | 还原性:F-<Cl-<Br- |
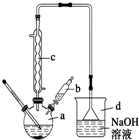 溴苯是一种常用的化工原料.实验室制备溴苯的实验步骤如下:
溴苯是一种常用的化工原料.实验室制备溴苯的实验步骤如下:步骤1:在a中加入15mL苯和少量铁屑,再将b中4.0mL液溴慢慢加入到a中,充分反应.
步骤2:向a中加入10mL水,然后过滤除去未反应的铁屑.
步骤3:滤液依次用10mL水、8mL 10%的NaOH溶液、10mL 水洗涤,分液得粗溴苯.
步骤4:向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤即得粗产品.
| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 在水中的溶解度 | 微溶 | 微溶 | 微溶 |
 ;
;(2)仪器c的名称是冷凝管,仪器d的作用是吸收HBr防污染,防倒吸;
(3)将b中的液溴慢慢加入到a中,而不能快速加入的原因是防止反应放出的热使C6H6、Br2挥发而影响产率;
(4)仪器c的作用是冷凝回流,回流的主要物质有C6H6、Br2(填化学式);
(5)步骤4得到的粗产品中还含有杂质苯,已知苯、溴苯的有关物理性质如上表,则要进一步提纯粗产品,还必须进行的实验操作名称是蒸馏.
(6)实验结束后,试设计实验方案检验d装置所得溶液中含有Br-:
实验操作:取少量d中溶液于试管中,滴加过量稀HNO3,再加入AgNO3溶液;
实验现象和结论:有淡黄色沉淀生成,溶液中含有Br-.
| A. | 苯、溴水、铁粉混合制成溴苯 | |
| B. | 甲烷与氯气光照制得纯净的一氯甲烷 | |
| C. | 乙烯通入溴的四氯化碳溶液得到1,2-二溴乙烷 | |
| D. | 用高锰酸钾溶液除去乙烷中的乙烯杂质 |
 某同学用乙醇、乙酸和浓硫酸制取乙酸乙酯,装置如图所示.
某同学用乙醇、乙酸和浓硫酸制取乙酸乙酯,装置如图所示.