题目内容
8.下列反应可用于设计原电池的是( )| A. | CO2+2H2O→CH4+2O2 | B. | NaOH+HCl=NaCl+H2O | ||
| C. | Cu+2HCl=Cu Cl2+H2↑ | D. | 4Al+3O2+6H2O=4Al(OH)3 |
分析 能设计成原电池的化学反应,必须是能自发进行的氧化还原反应,据此结合化合价变化情况对各选项进行判断.
解答 解:A.反应CO2+2H2O→CH4+2O2不能自发进行,且为吸热反应,无法设计成原电池,故A错误;
B.NaOH+HCl=NaCl+H2O为中和反应,不是氧化还原反应,不能设计成原电池,故B错误;
C.反应Cu+2HCl=CuCl2+H2↑不能自发进行,无法设计成原电池,故C错误;
D.4Al+3O2+6H2O=4Al(OH)3为氧化还原反应,可将化学能转化为电能,故D正确;
故选D.
点评 本题考查了原电池原理,题目难度不大,明确原电池反应类型是解本题关键,该反应必须是“自发进行的”、“放热的”、“氧化还原反应”,这几个特点必须同时具备,缺一不可,试题培养了学生的灵活应用能力.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
18.下列物质能促进水的电离的是( )
| A. | 碳酸钠 | B. | 醋酸 | C. | 乙醇 | D. | 氯化钠 |
19.在温度不变的条件下,在恒容的容器中进行下列反应:N2O4(g)═2NO2(g),若N2O4的浓度由0.1mol•L-1降到0.07mol•L-1需要15s,那么N2O4的浓度由0.07mol•L-1降到0.05mol•L-1所需的反应时间( )
| A. | 等于5s | B. | 等于10s | C. | 小于10s | D. | 大于10s |
16. 分子中苯环上的一个氢被-C4H9原子团取代形成的有机物共有( )
分子中苯环上的一个氢被-C4H9原子团取代形成的有机物共有( )
 分子中苯环上的一个氢被-C4H9原子团取代形成的有机物共有( )
分子中苯环上的一个氢被-C4H9原子团取代形成的有机物共有( )| A. | 12种 | B. | 10种 | C. | 9种 | D. | 6种 |
13.下列实验能获得成功的是( )
| A. | 苯、溴水、铁粉混合制成溴苯 | |
| B. | 甲烷与氯气光照制得纯净的一氯甲烷 | |
| C. | 乙烯通入溴的四氯化碳溶液得到1,2-二溴乙烷 | |
| D. | 用高锰酸钾溶液除去乙烷中的乙烯杂质 |
20.某航空站安装了一台燃料电池,该电池可同时提供电和水蒸气,所用燃料为氢气,电解质为熔融的碳酸钾.已知电池的总反应为2H2+O2=2H2O,正极反应为O2+2CO2+4e-=2CO32-.下列说法正确的是( )
| A. | 该电池可在常温或高温时工作,对环境有较强的适应性 | |
| B. | 负极反应为H2+2OH--2e-=2H2O | |
| C. | 该电池工作时负极有CO2生成 | |
| D. | 该电池供应2molH2O,同时转移2mol电子 |
17.下列各项判断完全正确的是( )
| 变化 | △H | △S | 方向性 | |
| A | H2O(l)→H2O(g) | >0 | <0 | 非自发 |
| B | 2NO2(g)?N2O4(g) | <0 | <0 | 自发 |
| C | 2Fe3+(aq)+Cu(s)=2Fe2+(aq)+Cu2+(aq) | >0 | >0 | 自发 |
| D | NH4Cl(s)=NH3(g)+HCl(g) | <0 | >0 | 非自发 |
| A. | A | B. | B | C. | C | D. | D |
18.青蒿酸是合成青蓠素的原科,其可以由香草醛合成:下列叙述正确的是( )
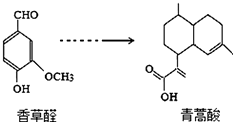

| A. | 在一定条件,香草醛可与HCHO发生缩聚反应 | |
| B. | 两种物质各1mol分别和氢气反应,最多消耗氢气4mol和3mol | |
| C. | 用FeCl3溶液可鉴别化合物香草醛和青蒿酸 | |
| D. | 青蒿酸分子中含有2个手性碳原子 |
