题目内容
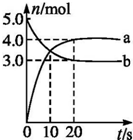 N2O5是一种新型硝化剂,其性质和制备受到人们的关注.一定温度下,在2L固定容积的密闭容器中发生反应2N2O5(g)?4NO2(g)+O2(g)△H>0.反应物和部分生成物的物质的量随反应时间变化的曲线如图所示.下列说法中,正确的是( )
N2O5是一种新型硝化剂,其性质和制备受到人们的关注.一定温度下,在2L固定容积的密闭容器中发生反应2N2O5(g)?4NO2(g)+O2(g)△H>0.反应物和部分生成物的物质的量随反应时间变化的曲线如图所示.下列说法中,正确的是( )| A、0~20 s内平均反应速率v(N2O5)=0.1 mol?(L?s)-1 |
| B、10 s时,正、逆反应速率相等,达到平衡 |
| C、20 s时,正反应速率大于逆反应速率 |
| D、曲线a表示NO2的物质的量随反应时间的变化 |
考点:物质的量或浓度随时间的变化曲线
专题:化学平衡专题
分析:A、根据v=
计算反应速率;
B、根据图中反应物和生成物的物质的变化来判断反应所处的状态,进而判断正逆反应速率的关系;
C、根据图中反应物和生成物的物质的变化来判断反应所处的状态,进而判断正逆反应速率的关系;
D、在反应2N2O5(g)?4NO2(g)+O2(g)中N2O5为反应物NO2为生成物,它们的计量数之比为1:2,也就是说NO2增加的物质的量是N2O5减小的物质的量的两倍,据此作判断.
| △c |
| △t |
B、根据图中反应物和生成物的物质的变化来判断反应所处的状态,进而判断正逆反应速率的关系;
C、根据图中反应物和生成物的物质的变化来判断反应所处的状态,进而判断正逆反应速率的关系;
D、在反应2N2O5(g)?4NO2(g)+O2(g)中N2O5为反应物NO2为生成物,它们的计量数之比为1:2,也就是说NO2增加的物质的量是N2O5减小的物质的量的两倍,据此作判断.
解答:
解:A、在反应2N2O5(g)?4NO2(g)+O2(g)中N2O5为反应物NO2为生成物,它们的计量数之比为1:2,也就是说NO2增加的物质的量是N2O5减小的物质的量的两倍,所以曲线a表示NO2的物质的量随反应时间的变化,曲线b表示N2O5的物质的量随反应时间的变化,根据v=
=
=0.05 mol?(L?s)-1,故A错误;
B、根据图中可知10 s时反应物还在继续减小而生成物还在继续增大,所以此时反应还在正向进行,即正反应速率大于逆反应速率,故B错误;
C、根据图中反应物和生成物的物质的变化情况可知,20 s时有关物质的物质的量不再随时间的变化而变化,即反应处于平衡状态,此时正逆反应速率相等,故C错误;
D、在反应2N2O5(g)?4NO2(g)+O2(g)中N2O5为反应物NO2为生成物,它们的计量数之比为1:2,也就是说NO2增加的物质的量是N2O5减小的物质的量的两倍,结合图中的数据可知曲线a表示NO2的物质的量随反应时间的变化,曲线b表示N2O5的物质的量随反应时间的变化,故D正确;
故选D.
| △c |
| △t |
| ||
| 20s |
B、根据图中可知10 s时反应物还在继续减小而生成物还在继续增大,所以此时反应还在正向进行,即正反应速率大于逆反应速率,故B错误;
C、根据图中反应物和生成物的物质的变化情况可知,20 s时有关物质的物质的量不再随时间的变化而变化,即反应处于平衡状态,此时正逆反应速率相等,故C错误;
D、在反应2N2O5(g)?4NO2(g)+O2(g)中N2O5为反应物NO2为生成物,它们的计量数之比为1:2,也就是说NO2增加的物质的量是N2O5减小的物质的量的两倍,结合图中的数据可知曲线a表示NO2的物质的量随反应时间的变化,曲线b表示N2O5的物质的量随反应时间的变化,故D正确;
故选D.
点评:本题考查了根据图象判断反应方向及反应速率,难度较小,解题的关键是把图象和题中的化学方程式有机结合起来分析.

练习册系列答案
相关题目
下列物质与其用途完全符合的是( )
①Na2CO3制玻璃 ②SiO2太阳能电池 ③AgI人工降雨 ④NaCl制纯碱 ⑤Al2O3焊接钢轨 ⑥NaClO消毒剂 ⑦Fe2O3红色油漆或涂料⑧HF(aq)雕刻玻璃.
①Na2CO3制玻璃 ②SiO2太阳能电池 ③AgI人工降雨 ④NaCl制纯碱 ⑤Al2O3焊接钢轨 ⑥NaClO消毒剂 ⑦Fe2O3红色油漆或涂料⑧HF(aq)雕刻玻璃.
| A、①③④⑥⑦⑧ |
| B、①②③⑤⑥⑦⑧ |
| C、①③⑤⑦⑧ |
| D、①②③④⑤⑥⑦ |
下列说法错误的是( )
| A、含有共价键的化合物不一定是共价化合物 |
| B、在共价化合物中一定含有共价键 |
| C、含有离子键的化合物一定是离子化合物 |
| D、离子键就是阴阳离子结合成化合物的静电引力 |
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、7.8 g苯中含有0.3NA个碳碳双键,0.3NA个碳碳单键 |
| B、5.6 g铁与足量的稀硝酸反应,失去电子数为0.2NA |
C、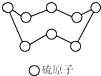 32g硫(结构见图)含S-S的数目为NA 32g硫(结构见图)含S-S的数目为NA |
| D、含0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1 NA |
工业酒精与用粮食发酵产生的酒精成份不完全相同.严禁用工业酒精勾兑食用酒,否则会使人双目失明甚至死亡.工业酒精中的主要有毒成份是( )
| A、甲醇 | B、甲醛 | C、甲酸 | D、甲苯 |
下列说法错误的是( )
A、按照系统命名法, 的名称为3,3,4-三甲基己烷 的名称为3,3,4-三甲基己烷 |
| B、乙醇、乙酸和乙酸乙酯可以用饱和Na2CO3溶液鉴别 |
| C、苯乙烯中所有原子可能共平面 |
D、1.0mol的 与NaOH溶液和Br2反应时,分别需要消耗NaOH 5.0mol和Br2 3.0mol 与NaOH溶液和Br2反应时,分别需要消耗NaOH 5.0mol和Br2 3.0mol |
 有两种位于短周期的相邻周期、相邻主族的非金属元素X、Y,已知两元素最高价氧化物的水化物均为强酸.根据下图转化关系(反应条件及部分产物已略去),回答下列问题:
有两种位于短周期的相邻周期、相邻主族的非金属元素X、Y,已知两元素最高价氧化物的水化物均为强酸.根据下图转化关系(反应条件及部分产物已略去),回答下列问题: