题目内容
下列物质与其用途完全符合的是( )
①Na2CO3制玻璃 ②SiO2太阳能电池 ③AgI人工降雨 ④NaCl制纯碱 ⑤Al2O3焊接钢轨 ⑥NaClO消毒剂 ⑦Fe2O3红色油漆或涂料⑧HF(aq)雕刻玻璃.
①Na2CO3制玻璃 ②SiO2太阳能电池 ③AgI人工降雨 ④NaCl制纯碱 ⑤Al2O3焊接钢轨 ⑥NaClO消毒剂 ⑦Fe2O3红色油漆或涂料⑧HF(aq)雕刻玻璃.
| A、①③④⑥⑦⑧ |
| B、①②③⑤⑥⑦⑧ |
| C、①③⑤⑦⑧ |
| D、①②③④⑤⑥⑦ |
考点:硅和二氧化硅,氯、溴、碘及其化合物的综合应用,钠的重要化合物,铁的氧化物和氢氧化物
专题:化学应用
分析:①制玻璃的原料有Na2CO3、CaCO3、SiO2;
②Si能制造太阳能电池;
③AgI能用于人工降雨;
④氨碱法制纯碱的实验原理进行分析,以食盐(氯化钠)、石灰石(经煅烧生成生石灰和二氧化碳)、氨气为原料来制取纯碱;
⑤利用铝热反应原理焊接钢轨;
⑥NaClO具有强氧化性,能杀菌消毒;
⑦Fe2O3为红棕色固体;
⑧HF(aq)能腐蚀玻璃.
②Si能制造太阳能电池;
③AgI能用于人工降雨;
④氨碱法制纯碱的实验原理进行分析,以食盐(氯化钠)、石灰石(经煅烧生成生石灰和二氧化碳)、氨气为原料来制取纯碱;
⑤利用铝热反应原理焊接钢轨;
⑥NaClO具有强氧化性,能杀菌消毒;
⑦Fe2O3为红棕色固体;
⑧HF(aq)能腐蚀玻璃.
解答:
解:①制玻璃的原料有Na2CO3、CaCO3、SiO2,所以Na2CO3能制造玻璃,故正确;
②Si能制造太阳能电池,二氧化硅是制造光导纤维的材料,故错误;
③AgI能用于人工降雨,故正确;
④氨碱法制纯碱的实验原理进行分析,以食盐(氯化钠)、石灰石(经煅烧生成生石灰和二氧化碳)、氨气为原料来制取纯碱,故正确;
⑤利用铝热反应原理焊接钢轨,用Al焊接钢轨,故错误;
⑥病毒属于蛋白质,NaClO具有强氧化性,能使蛋白质变性而杀菌消毒,故正确;
⑦Fe2O3为红棕色固体,能作红色油漆或涂料,故正确;
⑧玻璃的成分还有SiO2,4HF+SiO2=SiF4+2H2O,所以HF(aq)能腐蚀玻璃,故正确;
故选A.
②Si能制造太阳能电池,二氧化硅是制造光导纤维的材料,故错误;
③AgI能用于人工降雨,故正确;
④氨碱法制纯碱的实验原理进行分析,以食盐(氯化钠)、石灰石(经煅烧生成生石灰和二氧化碳)、氨气为原料来制取纯碱,故正确;
⑤利用铝热反应原理焊接钢轨,用Al焊接钢轨,故错误;
⑥病毒属于蛋白质,NaClO具有强氧化性,能使蛋白质变性而杀菌消毒,故正确;
⑦Fe2O3为红棕色固体,能作红色油漆或涂料,故正确;
⑧玻璃的成分还有SiO2,4HF+SiO2=SiF4+2H2O,所以HF(aq)能腐蚀玻璃,故正确;
故选A.
点评:本题考查了物质的用途,明确物质的性质是解本题关键,性质决定用途,用途体现性质,注意硅、二氧化硅的用途,为常考查点也是易错点.

练习册系列答案
相关题目
辨析以下的说法:
①l6O与l8O的转化可以通过化学反应实现;
②灼烧钠的化合物时火焰呈黄色,那是发生了化学反应;
③碱性氧化物一定是金属氧化物;
④只由一种元素组成的物质一定是纯净物;
⑤石墨与金刚石的转化是化学变化;
⑥5424Cr为铬的一种核素,其核外电子数为30.
上述说法中正确的是( )
①l6O与l8O的转化可以通过化学反应实现;
②灼烧钠的化合物时火焰呈黄色,那是发生了化学反应;
③碱性氧化物一定是金属氧化物;
④只由一种元素组成的物质一定是纯净物;
⑤石墨与金刚石的转化是化学变化;
⑥5424Cr为铬的一种核素,其核外电子数为30.
上述说法中正确的是( )
| A、①④⑤ | B、①③④ |
| C、③⑤ | D、②③⑥ |
下列各组物质均为同系物的是( )
①
②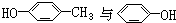
③CH4与C3H8
④1-丁烯与2-甲基丙烯
⑤CH3CH2COOH与CH3COOH
⑥乙醇与乙二醇.
①

②
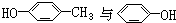
③CH4与C3H8
④1-丁烯与2-甲基丙烯
⑤CH3CH2COOH与CH3COOH
⑥乙醇与乙二醇.
| A、①④⑤ | B、①④⑥ |
| C、②③⑤ | D、④⑤⑥ |
实验室用锌粒与VmL浓度为10%的稀硫酸反应制取氢气,若向反应混合物中加入下列物质,关于反应速率v说法正确的是( )
| A、少量Na2SO4固体,v(H2)不变 |
| B、VmLNa2SO4溶液,v(H2)增大 |
| C、将稀硫酸改为浓硫酸,v(H2)增大 |
| D、VmL稀硝酸,v(H2)增大 |
如将物质按照单质、氧化物、酸、碱、盐分类,下列各组物质中,类别相同的是( )
| A、氧气、氧化镁、四氯化碳、水 |
| B、硫酸铜、氯化钠、碳酸钙、硫化钾 |
| C、硫酸、碳酸钠、氯化镁、氧化钠 |
| D、硝酸银、氢氧化钠、醋酸钠、氯化钾 |
把少量的溴水加入下列物质中充分振荡,上层有色,下层基本为无色的是( )
| A、苯 |
| B、CCl4 |
| C、乙醇 |
| D、已烯 |
设NA为阿伏加德罗常数的值.下列叙述不正确的是( )
| A、一定温度下,15g甲醛和乙酸的混合物中O原子数为0.5NA |
| B、标准状况下,NO和O2各11.2L混合,所得混合气体的分子总数为0.75NA |
| C、14g分子通式为CnH2n的链烃中含有的C=C的数目为NA/n |
| D、在反应KIO3+6HI=KI+3I2+3H2O中,每生成3mol I2转移的电子数为6NA |
下列有关电解质溶液中微粒的物质的量浓度关系正确的是( )
| A、在0.1 mol/L NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
| B、在0.1 mol/L Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+c(H2CO3) |
| C、向0.2mol/LNaHCO3溶液中加入等体积0.1 mol/LNaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
| D、0.2 mol/L的NaHCO3溶液中c(H+)+c(H2CO3)=c(CO32-)+c(OH-) |
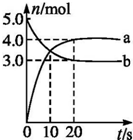 N2O5是一种新型硝化剂,其性质和制备受到人们的关注.一定温度下,在2L固定容积的密闭容器中发生反应2N2O5(g)?4NO2(g)+O2(g)△H>0.反应物和部分生成物的物质的量随反应时间变化的曲线如图所示.下列说法中,正确的是( )
N2O5是一种新型硝化剂,其性质和制备受到人们的关注.一定温度下,在2L固定容积的密闭容器中发生反应2N2O5(g)?4NO2(g)+O2(g)△H>0.反应物和部分生成物的物质的量随反应时间变化的曲线如图所示.下列说法中,正确的是( )| A、0~20 s内平均反应速率v(N2O5)=0.1 mol?(L?s)-1 |
| B、10 s时,正、逆反应速率相等,达到平衡 |
| C、20 s时,正反应速率大于逆反应速率 |
| D、曲线a表示NO2的物质的量随反应时间的变化 |