题目内容
二氧化碳是一种宝贵的碳氧资源.以CO2和NH3为原料合成尿素是固定和利用CO2的成功范例.在尿素合成塔中的主要反应可表示如下:
反应Ⅰ:2NH3(g)+CO2(g)═NH2CO2NH4(s)△H1=a kJ?mol-1
反应Ⅱ:NH2CO2NH4(s)═CO(NH2)2(s)+H2O(g)△H2=+72.49kJ?mol-1
总反应Ⅲ:2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(g)△H3=-86.98kJ?mol-1
请回答下列问题:
(1)反应Ⅰ的△H1= kJ?mol-1(用具体数据表示).
(2)反应Ⅱ一般在 情况下有利于该反应的进行.
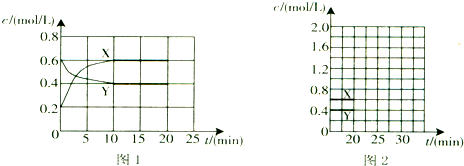
(3)反应Ⅲ中影响CO2平衡转化率的因素很多,下图1为某特定条件下,不同水碳比
和温度影响CO2平衡转化率变化的趋势曲线.
①其他条件相同时,为提高CO2的平衡转化率,生产中可以采取的措施是 (填提高或降低)水碳比.
②当温度高于190℃后,CO2平衡转化率出现如图1所示的变化趋势,其原因是 .
(4)反应Ⅰ的平衡常数表达式K1= ;如果起始温度相同,反应Ⅰ由在恒温容器进行改为在绝热(与外界没有热量交换)容器中进行,平衡常数K1将 (填增大、减少、不变).
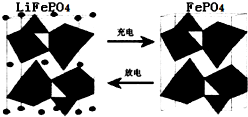
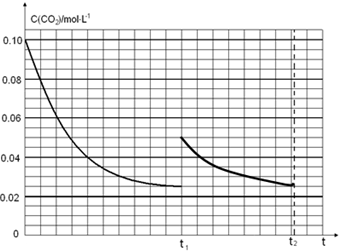
(5)某研究小组为探究反应Ⅰ中影响c(CO2)的因素,在恒温下将0.4molNH3和0.2molCO2放入容积为2L的密闭容器中,t1时达到平衡过程中c(CO2)随时间t变化趋势曲线如上图2所示.若其他条件不变,t1时将容器体积压缩到1L,请画出t1后c(CO2)随时间t变化趋势曲线(t2达到新的平衡).
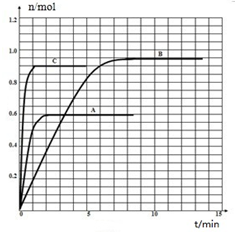
(6)由CO2形成的熔融碳酸盐做电解质的燃料电池(MCFC),从技术发展趋势来看,是未来民用发电的理想选择方案之一.现以H2(g)、CO(g)为燃料,以一定比例Li2CO3和Na2CO3低熔混合物为电解质(如图3).写出碳酸盐燃料电池(MCFC)正极电极反应式 .

反应Ⅰ:2NH3(g)+CO2(g)═NH2CO2NH4(s)△H1=a kJ?mol-1
反应Ⅱ:NH2CO2NH4(s)═CO(NH2)2(s)+H2O(g)△H2=+72.49kJ?mol-1
总反应Ⅲ:2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(g)△H3=-86.98kJ?mol-1
请回答下列问题:
(1)反应Ⅰ的△H1=
(2)反应Ⅱ一般在
(3)反应Ⅲ中影响CO2平衡转化率的因素很多,下图1为某特定条件下,不同水碳比
| n(H2O) |
| n(CO2) |
①其他条件相同时,为提高CO2的平衡转化率,生产中可以采取的措施是
②当温度高于190℃后,CO2平衡转化率出现如图1所示的变化趋势,其原因是
(4)反应Ⅰ的平衡常数表达式K1=
(5)某研究小组为探究反应Ⅰ中影响c(CO2)的因素,在恒温下将0.4molNH3和0.2molCO2放入容积为2L的密闭容器中,t1时达到平衡过程中c(CO2)随时间t变化趋势曲线如上图2所示.若其他条件不变,t1时将容器体积压缩到1L,请画出t1后c(CO2)随时间t变化趋势曲线(t2达到新的平衡).
(6)由CO2形成的熔融碳酸盐做电解质的燃料电池(MCFC),从技术发展趋势来看,是未来民用发电的理想选择方案之一.现以H2(g)、CO(g)为燃料,以一定比例Li2CO3和Na2CO3低熔混合物为电解质(如图3).写出碳酸盐燃料电池(MCFC)正极电极反应式
考点:物质的量或浓度随时间的变化曲线,常见化学电源的种类及其工作原理,化学平衡建立的过程,化学平衡的影响因素
专题:基本概念与基本理论
分析:(1)依据热化学方程式和盖斯定律计算分析;
(2)依据反应自发进行的判断依据是△H-T△S<0分析;
(3)①不同水碳比
和温度影响CO2平衡转化率变化的趋势曲线分析可知;
②反应Ⅲ是放热反应,升温平衡逆向进行;
(4)依据热化学方程式2NH3(g)+CO2(g)?NH2CO2NH4(s)△H1=a kJ?mol-1 ,结合平衡常数的概念书写;
(5)图象分析二氧化碳的平衡浓度为0.025mol/L,体积缩小一半浓度增大一倍应为0.05mol/L,随反应进行达到平衡状态,因为生成物为固体,最后达到相同平衡状态,二氧化碳浓度不变,据此画出变化曲线;
(6)根据电极上得失电子书写电极反应式.
(2)依据反应自发进行的判断依据是△H-T△S<0分析;
(3)①不同水碳比
| n(H2O) |
| n(CO2) |
②反应Ⅲ是放热反应,升温平衡逆向进行;
(4)依据热化学方程式2NH3(g)+CO2(g)?NH2CO2NH4(s)△H1=a kJ?mol-1 ,结合平衡常数的概念书写;
(5)图象分析二氧化碳的平衡浓度为0.025mol/L,体积缩小一半浓度增大一倍应为0.05mol/L,随反应进行达到平衡状态,因为生成物为固体,最后达到相同平衡状态,二氧化碳浓度不变,据此画出变化曲线;
(6)根据电极上得失电子书写电极反应式.
解答:
解:(1)反应Ⅰ:2NH3(g)+CO2(g)?NH2CO2NH4(s)△H1=a kJ?mol-1
反应Ⅱ:NH2CO2NH4(s)?CO(NH2)2(s)+H2O(g)△H2=+72.49kJ?mol-1
总反应Ⅲ:2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)△H3=-86.98kJ?mol-1
由盖斯定律总反应Ⅲ-反应Ⅱ,得到2NH3(g)+CO2(g)?NH2CO2NH4(s)△H1=a=-159.47kJ?mol-1,
故答案为:-159.47;
(2)反应Ⅱ:NH2CO2NH4(s)?CO(NH2)2(s)+H2O(g)△H2=+72.49kJ?mol-1,∵△S>0,△H>0,所以依据反应自发进行的判断依据△H-T△S<0,需要在高温下反应自发进行,故答案为:高温;
(3)①反应Ⅲ:2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)△H3=-86.98kJ?mol-1,其他条件相同时,为提高CO2的平衡转化率,平衡正向进行,依据图象中的水碳比数据分析判断,生产中可以采取的措施是降低水碳比,二氧化碳转化率增大,故答案为:降低;
②反应Ⅲ:2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)△H3=-86.98kJ?mol-1,是放热反应,升温高于190°C,依据图象分析可知,二氧化碳转化率减小,因为温度升高,平衡逆向进行,
故答案为:温度高于190℃时,因为反应Ⅲ是放热反应,温度升高平衡向逆方向进行,CO2的平衡转化率降低;
(4)反应Ⅰ:2NH3(g)+CO2(g)?NH2CO2NH4(s)△H1=-159.47kJ?mol-1,平衡常数K=
;
起始温度相同,反应Ⅰ由在恒温容器进行改为在绝热(与外界没有热量交换)容器中进行,反应是放热反应,随反应进行温度升高平衡逆向进行,平衡常数减小,
故答案为:
;减少;
(5)在恒温下将0.4mol NH3和0.2mol CO2放入容积为2L的密闭容器中,达到平衡时,
2NH3(g)+CO2(g)?NH2CO2NH4(s)
起始量(mol/L) 0.2 0.1 0
变化量(mol/L) 0.15 0.075
平衡量(mol/L) 0.05 0.025
t1时达到平衡过程中c(CO2)随时间t变化趋势曲线如图2所示.若其他条件不变,t1时将容器体积压缩到1L,二氧化碳浓度应增大到0.05mol/L,压强增大,平衡正向进行,由于生成物是固体,所以达到平衡状态,二氧化碳浓度保持不变,据此画出变化曲线为:
 ,故答案为:
,故答案为: ;
;
(6)碳酸盐燃料电池正极上氧气得电子和二氧化碳反应生成碳酸根离子,电极反应式为O2+4e-+2CO2=2CO32-,故答案为:O2+4e-+2CO2=2CO32-.
反应Ⅱ:NH2CO2NH4(s)?CO(NH2)2(s)+H2O(g)△H2=+72.49kJ?mol-1
总反应Ⅲ:2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)△H3=-86.98kJ?mol-1
由盖斯定律总反应Ⅲ-反应Ⅱ,得到2NH3(g)+CO2(g)?NH2CO2NH4(s)△H1=a=-159.47kJ?mol-1,
故答案为:-159.47;
(2)反应Ⅱ:NH2CO2NH4(s)?CO(NH2)2(s)+H2O(g)△H2=+72.49kJ?mol-1,∵△S>0,△H>0,所以依据反应自发进行的判断依据△H-T△S<0,需要在高温下反应自发进行,故答案为:高温;
(3)①反应Ⅲ:2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)△H3=-86.98kJ?mol-1,其他条件相同时,为提高CO2的平衡转化率,平衡正向进行,依据图象中的水碳比数据分析判断,生产中可以采取的措施是降低水碳比,二氧化碳转化率增大,故答案为:降低;
②反应Ⅲ:2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)△H3=-86.98kJ?mol-1,是放热反应,升温高于190°C,依据图象分析可知,二氧化碳转化率减小,因为温度升高,平衡逆向进行,
故答案为:温度高于190℃时,因为反应Ⅲ是放热反应,温度升高平衡向逆方向进行,CO2的平衡转化率降低;
(4)反应Ⅰ:2NH3(g)+CO2(g)?NH2CO2NH4(s)△H1=-159.47kJ?mol-1,平衡常数K=
| 1 |
| c(CO2)c2(NH3) |
起始温度相同,反应Ⅰ由在恒温容器进行改为在绝热(与外界没有热量交换)容器中进行,反应是放热反应,随反应进行温度升高平衡逆向进行,平衡常数减小,
故答案为:
| 1 |
| c(CO2)c2(NH3) |
(5)在恒温下将0.4mol NH3和0.2mol CO2放入容积为2L的密闭容器中,达到平衡时,
2NH3(g)+CO2(g)?NH2CO2NH4(s)
起始量(mol/L) 0.2 0.1 0
变化量(mol/L) 0.15 0.075
平衡量(mol/L) 0.05 0.025
t1时达到平衡过程中c(CO2)随时间t变化趋势曲线如图2所示.若其他条件不变,t1时将容器体积压缩到1L,二氧化碳浓度应增大到0.05mol/L,压强增大,平衡正向进行,由于生成物是固体,所以达到平衡状态,二氧化碳浓度保持不变,据此画出变化曲线为:
 ,故答案为:
,故答案为: ;
;(6)碳酸盐燃料电池正极上氧气得电子和二氧化碳反应生成碳酸根离子,电极反应式为O2+4e-+2CO2=2CO32-,故答案为:O2+4e-+2CO2=2CO32-.
点评:本题考查了热化学方程式和盖斯定律的计算应用,化学平衡影响因素分析判断,平衡常数,图象绘制与分析,电化学等掌握基础知识,有一定的综合性,题目难度中等.

练习册系列答案
相关题目
把少量的溴水加入下列物质中充分振荡,上层有色,下层基本为无色的是( )
| A、苯 |
| B、CCl4 |
| C、乙醇 |
| D、已烯 |
对于学生来讲,“学会生存”比学习知识更重要.下列叙述错误的是( )
| A、快速逃离火灾现场时,应用湿毛巾捂口鼻弯腰呼吸,因为许多易燃有机高分子材料燃烧时会释放出大量有毒气体,而且热气体的密度比空气轻 |
| B、吃米饭或馒头时,多加咀嚼会感到甜味,是因为淀粉发生水解反应生成了麦芽糖 |
| C、油脂是人类的主要食物之一,“地沟油”对人体的危害极大 |
| D、肥皂的去污原理与合成洗涤剂的去污原理不同 |
常温下,分别将4块形状相同,质量均为7g的铁片同时放入下列4种溶液中,产生气体速率最大的是( )
| A、150mL 2mol?L-1盐酸 |
| B、150mL 2mol?L-1硫酸 |
| C、500mL 3mol?L-1盐酸 |
| D、500mL 18.4mol?L-1硫酸 |
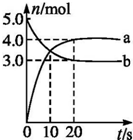 N2O5是一种新型硝化剂,其性质和制备受到人们的关注.一定温度下,在2L固定容积的密闭容器中发生反应2N2O5(g)?4NO2(g)+O2(g)△H>0.反应物和部分生成物的物质的量随反应时间变化的曲线如图所示.下列说法中,正确的是( )
N2O5是一种新型硝化剂,其性质和制备受到人们的关注.一定温度下,在2L固定容积的密闭容器中发生反应2N2O5(g)?4NO2(g)+O2(g)△H>0.反应物和部分生成物的物质的量随反应时间变化的曲线如图所示.下列说法中,正确的是( )| A、0~20 s内平均反应速率v(N2O5)=0.1 mol?(L?s)-1 |
| B、10 s时,正、逆反应速率相等,达到平衡 |
| C、20 s时,正反应速率大于逆反应速率 |
| D、曲线a表示NO2的物质的量随反应时间的变化 |
下列反应中,不属于放热反应的是( )
| A、木炭燃烧 |
| B、生石灰与水反应 |
| C、酸碱中和反应 |
| D、Ba(OH)2?8H2O晶体与NH4Cl晶体反应 |
 (1)在一个容积为2L的密闭容器中,充入1mol SO2和1mol O2,一定条件下发生反应2SO2+O2?2SO3,3分钟后测得SO3的物质的量为0.6mol,则此时O2的物质的量浓度为
(1)在一个容积为2L的密闭容器中,充入1mol SO2和1mol O2,一定条件下发生反应2SO2+O2?2SO3,3分钟后测得SO3的物质的量为0.6mol,则此时O2的物质的量浓度为