题目内容
二氧化锰可用作干电池去极剂,合成工业的催化剂和氧化剂,玻璃工业和搪瓷工业的着色剂、消色剂、脱铁剂等.
Ⅰ.(1)锌-锰碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.电池的总反应式为Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s).电池的正极反应式为
Ⅱ.某化学研究性学习小组拟从废旧干电池中回收二氧化锰制取碳酸锰.
①将干电池剖切、分选得到黑色混合物(主要成分为MnO2)洗涤、过滤、烘干.
②将上述固体按固液体积比2:9加入浓盐酸、加热,反应完全后过滤、浓缩.
③向上述溶液中加入Na2CO3溶液,边加边搅拌,再过滤即可得到碳酸锰.
(2)在第②步中,将上述固体与浓盐酸混合的目的是
(3)有人认为,将第③步中的Na2CO3溶液换成NH4HCO3溶液,也能达到上述目的,但同时有气体生成.请写出加入NH4HCO3溶液时发生的离子反应方程式:
Ⅲ.湿法炼锰即电解硫酸锰溶液法.电解锰的生产过程分为化合浸取、氧化净化及沉淀除杂、产品回收.其生产工艺流程如下:
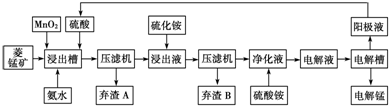
已知:①菱锰矿中主要成份是碳酸锰,主要杂质是Fe2+、Co2+、Ni2+.
②生成氢氧化物的pH如下表:(若某离子浓度小于等于10-5mol/L,则认为完全沉淀)
③有关难溶氢氧化物和硫化物pKsp数据(pKsp=-lgKsp):
(4)菱锰矿粉与硫酸反应的化学方程式是 .
(5)使用氨水的目的是调节pH值在 之间(填pH范围,精确到小数点后1位数字).在“浸出液”中加入(NH4)2S(硫化铵)的目的是
(6)电解槽中使用的是惰性电极板,电解反应方程式为 .
Ⅰ.(1)锌-锰碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.电池的总反应式为Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s).电池的正极反应式为
Ⅱ.某化学研究性学习小组拟从废旧干电池中回收二氧化锰制取碳酸锰.
①将干电池剖切、分选得到黑色混合物(主要成分为MnO2)洗涤、过滤、烘干.
②将上述固体按固液体积比2:9加入浓盐酸、加热,反应完全后过滤、浓缩.
③向上述溶液中加入Na2CO3溶液,边加边搅拌,再过滤即可得到碳酸锰.
(2)在第②步中,将上述固体与浓盐酸混合的目的是
(3)有人认为,将第③步中的Na2CO3溶液换成NH4HCO3溶液,也能达到上述目的,但同时有气体生成.请写出加入NH4HCO3溶液时发生的离子反应方程式:
Ⅲ.湿法炼锰即电解硫酸锰溶液法.电解锰的生产过程分为化合浸取、氧化净化及沉淀除杂、产品回收.其生产工艺流程如下:

已知:①菱锰矿中主要成份是碳酸锰,主要杂质是Fe2+、Co2+、Ni2+.
②生成氢氧化物的pH如下表:(若某离子浓度小于等于10-5mol/L,则认为完全沉淀)
| 物质 | Fe(OH)2 | Ni(OH)2 | Co(OH)2 | Mn(OH)2 |
| 开始沉淀pH | 7.5 | 7.7 | 7.6 | 8.3 |
| 完全沉淀pH | 9.7 | 8.4 | 8.2 | 9.8 |
| 难溶物质 | Fe(OH)3 | Ni(OH)2 | Co(OH)2 | NiS | CoS |
| pKsp | 38.55 | 15.26 | 14.7 | 18.49 | 20.40 |
(5)使用氨水的目的是调节pH值在
(6)电解槽中使用的是惰性电极板,电解反应方程式为
考点:物质分离和提纯的方法和基本操作综合应用,常见化学电源的种类及其工作原理,难溶电解质的溶解平衡及沉淀转化的本质
专题:实验设计题,电化学专题
分析:(1)根据电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s),可知反应中Zn被氧化,为原电池的负极,负极反应为Zn-2e-+2OH-═Zn(OH)2,MnO2为原电池的正极,发生还原反应,正极反应为2MnO2(s)+H2O(1)+2e-═Mn2O3(s)+2OH-(aq);
(2)在第②步中,将上述固体与浓盐酸混合的目的是利用浓盐酸还原二氧化锰为锰离子;
(3)将第③步中的Na2CO3溶液换成NH4HCO3溶液,也能达到上述目的,但同时有气体生成为二氧化碳气体;
(4)菱锰矿粉与硫酸反应生成硫酸锰二氧化碳和水;
(5)氨水可以将铁离子沉淀,根据氢氧化铁的Ksp来计算完全沉淀铁离子所需的溶液的pH即可,硫化铵可以将钴离子以及镍离子沉淀;
(6)根据电解池的工作原理来回答即可.
(2)在第②步中,将上述固体与浓盐酸混合的目的是利用浓盐酸还原二氧化锰为锰离子;
(3)将第③步中的Na2CO3溶液换成NH4HCO3溶液,也能达到上述目的,但同时有气体生成为二氧化碳气体;
(4)菱锰矿粉与硫酸反应生成硫酸锰二氧化碳和水;
(5)氨水可以将铁离子沉淀,根据氢氧化铁的Ksp来计算完全沉淀铁离子所需的溶液的pH即可,硫化铵可以将钴离子以及镍离子沉淀;
(6)根据电解池的工作原理来回答即可.
解答:
解:(1)根据电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s),可知反应中Zn被氧化,为原电池的负极,负极反应为Zn-2e-+2OH-═Zn(OH)2,MnO2为原电池的正极,发生还原反应,正极反应为2MnO2+2e-+H2O═Mn2O3+2OH-;
故答案为:2MnO2+2e-+H2O═Mn2O3+2OH-;
(2)在第②步中,将上述固体与浓盐酸混合的目的是利用浓盐酸还原二氧化锰为锰离子;
故答案为:将MnO2 还原成Mn2+;
(3)将第③步中的Na2CO3溶液换成NH4HCO3溶液,也能达到上述目的,但同时有气体生成为二氧化碳气体,反应的离子方程式为:Mn2++2HCO3-=MnCO3↓+CO2↑+H2O;
故答案为:Mn2++2HCO3-=MnCO3↓+CO2↑+H2O;
(4)菱锰矿粉与硫酸反应的化学方程式是:MnCO3+H2SO4═MnSO4+H2O+CO2↑,故答案为:MnCO3+H2SO4═MnSO4+H2O+CO2↑;
(5)氨水可以将铁离子沉淀,氢氧化铁的Ksp=c3(OH-)?c(Fe3+),铁离子完全沉淀时,铁离子的浓度是1×10-5mol/L,此时c(OH-)=
≈10-11.2mol/L,所以c(H+)=10-3.8mol/L,所以pH=3.8,所以将铁离子沉淀完全,但是锰离子未沉淀的范围是3.8~8.3,此范围内Co2+已经沉淀完全,所以再加入硫化铵将Ni2+沉淀,故答案为:3.8~8.3;作沉淀剂,将Ni2+沉淀;
(6)根据电解池的工作原理,电解硫酸锰溶液生成锰、硫酸和氧气,电解反应方程式为:2MnSO4+2H2O
2H2SO4+O2↑+2Mn,
故答案为:2MnSO4+2H2O
2H2SO4+O2↑+2Mn.
故答案为:2MnO2+2e-+H2O═Mn2O3+2OH-;
(2)在第②步中,将上述固体与浓盐酸混合的目的是利用浓盐酸还原二氧化锰为锰离子;
故答案为:将MnO2 还原成Mn2+;
(3)将第③步中的Na2CO3溶液换成NH4HCO3溶液,也能达到上述目的,但同时有气体生成为二氧化碳气体,反应的离子方程式为:Mn2++2HCO3-=MnCO3↓+CO2↑+H2O;
故答案为:Mn2++2HCO3-=MnCO3↓+CO2↑+H2O;
(4)菱锰矿粉与硫酸反应的化学方程式是:MnCO3+H2SO4═MnSO4+H2O+CO2↑,故答案为:MnCO3+H2SO4═MnSO4+H2O+CO2↑;
(5)氨水可以将铁离子沉淀,氢氧化铁的Ksp=c3(OH-)?c(Fe3+),铁离子完全沉淀时,铁离子的浓度是1×10-5mol/L,此时c(OH-)=
| 3 |
| ||
(6)根据电解池的工作原理,电解硫酸锰溶液生成锰、硫酸和氧气,电解反应方程式为:2MnSO4+2H2O
| ||
故答案为:2MnSO4+2H2O
| ||
点评:本题考查了物质分离流程分析,物质性质理解应用,主要是分离混合物的实验过程分析判断,掌握基础是关键,题目难度中等.

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
用NA表示阿伏伽德罗常数.下列说法正确的是( )
| A、标准状况下,11.2L乙烯含有的极性共价键数为NA |
| B、常温下,5.6LNO和5.6LO2的混合气体中含有的分子数为0.5NA |
| C、16.9gBaO2固体中阴、阳离子总数为0.2NA. |
| D、常温常压下,28g氮气含有的核外电子数为10 NA |
以下是一些常用的危险品标志,如图所列物质与危险警告标志对应错误的是( )
A、 氯气 |
B、 四氯化碳 |
C、 氢氧化钠 |
D、 KNO3 KNO3 |
 某学校同学进行乙醇的化学性质实验探究学习,以下为他们的学习过程.
某学校同学进行乙醇的化学性质实验探究学习,以下为他们的学习过程.