题目内容
用AgNO3溶液和NaCl、MgCl2、AlCl3三种溶液分别反应时,若把同体积、同物质的量浓度的三种溶液中的Cl-全部沉淀下来,所需AgNO3溶液的体积比是 ,若把同体积的三种溶液中的Cl-全部沉淀下来,所用AgNO3溶液的体积相同,则此三种溶液中溶质的物质的量浓度之比为 .生成沉淀的质量比为 .
考点:离子方程式的有关计算
专题:
分析:三种溶液中的Cl-完全沉淀,所消耗的Ag+的物质的量相同,由Ag+和Cl-反应方程式可知三种溶液中Cl-的物质的量相等,根据Cl-+Ag+=AgCl↓计算需同物质的量浓度的AgNO3溶液的体积;
三种溶液中的Cl-完全沉淀,所消耗的Ag+的物质的量相同,由Ag+和Cl-反应方程式可知三种溶液中Cl-的物质的量相等,三种溶液的体积又相等,说明三种溶液中c(Cl-)相等,再由三种溶质的构成求出三种溶液的物质的量的浓度比,生成的氯化银沉淀的物质的量等于银离子的物质的量.
三种溶液中的Cl-完全沉淀,所消耗的Ag+的物质的量相同,由Ag+和Cl-反应方程式可知三种溶液中Cl-的物质的量相等,三种溶液的体积又相等,说明三种溶液中c(Cl-)相等,再由三种溶质的构成求出三种溶液的物质的量的浓度比,生成的氯化银沉淀的物质的量等于银离子的物质的量.
解答:
解:同体积同物质的量浓度的NaCl、MgCl2、AlCl3三种溶液中的Cl-的物质的量之比为:1:2:3,根据Cl-+Ag+=AgCl↓,可知n(AgNO3)=n(Cl-),
则需同物质的量浓度的AgNO3溶液的体积比为1:2:3;
由n=c?V可知使三种溶液中的Cl-完全沉淀时所消耗的n(Ag+)相同,根据Ag++Cl-═AgCl↓可知三种溶液中n(Cl-)=n(Ag+),由于三种溶液的体积相等,所以三种溶液中c(Cl-)相等,设三种溶液的物质的量浓度分别为C(NaCl)、C(MgCl2)、C(AlCl3),则三种溶液中氯离子浓度满足关系C(NaCl)=2C(MgCl2)=3C(AlCl3),则C(NaCl):C(MgCl2):C(AlCl3)=6:3:2,三种溶液消耗银离子的物质的量相同,所以生成沉淀氯化银的物质的量相同,质量相同,质量之比为1:1:1;
故答案为:1:2:3;6:3:2;1:1:1.
则需同物质的量浓度的AgNO3溶液的体积比为1:2:3;
由n=c?V可知使三种溶液中的Cl-完全沉淀时所消耗的n(Ag+)相同,根据Ag++Cl-═AgCl↓可知三种溶液中n(Cl-)=n(Ag+),由于三种溶液的体积相等,所以三种溶液中c(Cl-)相等,设三种溶液的物质的量浓度分别为C(NaCl)、C(MgCl2)、C(AlCl3),则三种溶液中氯离子浓度满足关系C(NaCl)=2C(MgCl2)=3C(AlCl3),则C(NaCl):C(MgCl2):C(AlCl3)=6:3:2,三种溶液消耗银离子的物质的量相同,所以生成沉淀氯化银的物质的量相同,质量相同,质量之比为1:1:1;
故答案为:1:2:3;6:3:2;1:1:1.
点评:本题考查了有关离子方程式的计算,明确离子反应的实质和电解质与所含离子浓度之间的关系是解题关键,题目难度不大.

练习册系列答案
 全能测控一本好卷系列答案
全能测控一本好卷系列答案
相关题目
现有X、Y、Z、W四种元素,彼此问能发生如下反应:2Y-+W2=2W-+Y2;2Y-+X2=2X-+Y2 ;2W-+X2=2X-+W2 ;2X-+Z2=2Z-+X2 ;其中氧化剂的氧化能力由强到弱的顺序是( )
| A、X2>Y2>Z2>W2 |
| B、Y2>W2>X2>Z2 |
| C、Z2>X2>W2>Y2 |
| D、W2>X2>Z2>Y2 |
下列离子方程式书写正确的是( )
| A、碳酸钙与稀盐酸反应:CO32-+2H+=CO2↑+H2O |
| B、铁片与氯化铜溶液反应:Fe+Cu2+=Cu+Fe2+ |
| C、氢氧化镁溶于盐酸:Mg(OH)2+2H+=Mg2++2H2O |
| D、铁与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ |
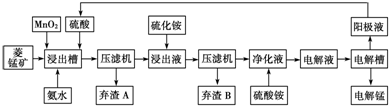
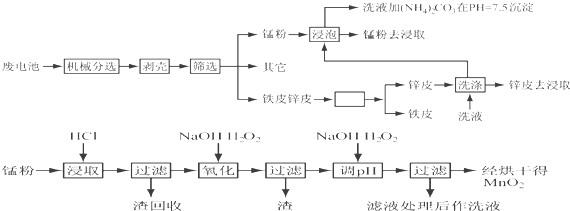
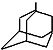
 可表示为
可表示为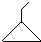 ,则金刚乙烷、金刚乙胺的结构简式可用下图表示.
,则金刚乙烷、金刚乙胺的结构简式可用下图表示.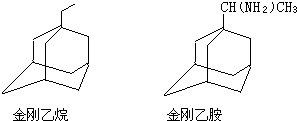
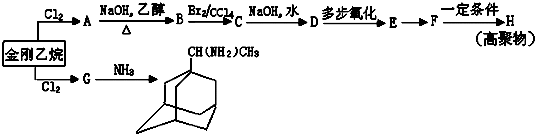
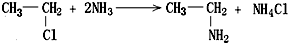
 ,如金刚乙烷表示为R-CH2CH3)
,如金刚乙烷表示为R-CH2CH3)