题目内容
中学化学中很多“规律”都有其使用范围,据有关“规律”下列推论合理的是( )
| A、根据较强酸可以制取较弱酸的规律,漂白粉溶液中通入过量的SO2的反应原理:ClO-+SO2+H2O═HSO3-+HClO | ||||
B、根据金属镁可以通过电解MgCl2制得,则工业制铝原理:2AlCl3
| ||||
| C、根据FeBr2溶液中通入少量Cl2使溶液变黄,则FeI2溶液中通入少量Cl2的离子方程式为:2Fe2++Cl2═2Fe3++2Cl- | ||||
| D、MgCl2中通足量氨水,有白色沉淀生成,则AlCl3中通足量氨水的离子方程式为:Al3++3NH3?H2O═Al(OH)3+3NH4+ |
考点:离子方程式的书写
专题:离子反应专题
分析:A.次氯酸具有强氧化性,能够氧化二氧化硫;
B.氯化铝为共价化合物,熔融氯化铝不导电,无法电解熔融氯化铝获得金属铝;
C.碘离子还原性大于亚铁离子,氯气少量,碘离子优先与氯气反应;
D.氨水碱性较弱,氨水能够与氯化铝的反应与氨水与氯化镁的反应类似,二者反映生成氢氧化铝沉淀.
B.氯化铝为共价化合物,熔融氯化铝不导电,无法电解熔融氯化铝获得金属铝;
C.碘离子还原性大于亚铁离子,氯气少量,碘离子优先与氯气反应;
D.氨水碱性较弱,氨水能够与氯化铝的反应与氨水与氯化镁的反应类似,二者反映生成氢氧化铝沉淀.
解答:
解:A.由于次氯酸具有强氧化性,反应生成的次氯酸能够将亚硫酸根离子氧化成硫酸根离子,正确离子方程式为:Ca2++2ClO-+2H2O+2SO2═CaSO4↓+SO42-+4H++2Cl-,故A错误;
B.氯化镁为离子化合物,能够电解氯化镁获得金属镁,而氯化铝为共价化合物,熔融氯化铝不导电,所以无法通过电解氯化铝获得金属铝,工业上通过电解熔融氧化铝获得金属铝,正确的反应方程式为:2Al2O3
2Al+3O2↑,故B错误;
C.碘离子还原性大于亚铁离子,少量氯气通入碘化亚铁溶液中,碘离子优先反应,正确的离子方程式为:2I-+Cl2═I2+2Cl-,故C错误;
D.一水合氨碱性较弱,氯化铝与氨水反应生成氢氧化铝沉淀,反应的离子方程式为:Al3++3NH3?H2O═Al(OH)3+3NH4+,该反应规律合理,故D正确;
故选D.
B.氯化镁为离子化合物,能够电解氯化镁获得金属镁,而氯化铝为共价化合物,熔融氯化铝不导电,所以无法通过电解氯化铝获得金属铝,工业上通过电解熔融氧化铝获得金属铝,正确的反应方程式为:2Al2O3
| ||
C.碘离子还原性大于亚铁离子,少量氯气通入碘化亚铁溶液中,碘离子优先反应,正确的离子方程式为:2I-+Cl2═I2+2Cl-,故C错误;
D.一水合氨碱性较弱,氯化铝与氨水反应生成氢氧化铝沉淀,反应的离子方程式为:Al3++3NH3?H2O═Al(OH)3+3NH4+,该反应规律合理,故D正确;
故选D.
点评:本题考查了离子方程式、化学方程式的判断,为高考中的高频题,属于中等难度的试题,注意掌握化学方程式、离子方程式的书写原则,正确分析题干信息为解答关键,试题有利于培养学生灵活应用所学知识的能力.

练习册系列答案
 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
相关题目
下列物质可通过化合反应直接制得到的是( )
| A、Cu(OH)2 |
| B、Ba(OH)2 |
| C、H2SiO3 |
| D、H2SO4 |
下列物质中,熔融状态不能导电的电解质是( )
| A、Na2SO4 |
| B、NaOH |
| C、C2H5OH |
| D、H2SO4 |
已知:2CO (g)+O2 (g)═2CO2 (g);△H1=-566kJ?mol-1 Na2O2(s)+CO2(g)=Na2CO3(g)+O2(g);△H2=-226kJ?mol-1 根据以上热化学方程式判断,下列说法正确的是( )
| A、CO的燃烧热为283kJ |
| B、2Na2O2(s)+2CO2(s)=2Na2CO3(g)+2O2(g);△H3>-452kJ?mol-1 |
C、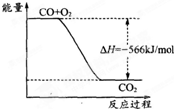 如图可表示由CO生成CO2的反应过程和能量关系 |
| D、CO(g)与Na2O2 (s)反应放出509kJ热量时,电子转移数约为6.02×1023 |
下列变化:①导电、②爆炸、③缓慢氧化、④变色、⑤无水硫酸铜吸水、⑥工业制氧气、⑦白磷变成红磷、⑧久置浓HNO3变黄,一定属于化学变化的是( )
| A、①④ | B、⑥⑧ |
| C、②⑥⑦ | D、③⑤⑦⑧ |
短周期元素Q、W、X、Y、Z的原子序数依次增大,X元素的颜色反应呈黄色,Q原子的最外层电子数是其内层电子数的2倍,W、Z原子的最外层电子数相同,Z元素的核电荷数是W的2倍,Y是地壳中含量最多的金属元素.下列说法不正确的是( )
| A、工业上常用电解的方法制备X、Y的单质 |
| B、元素Q和Z能形成QZ2型的共价化合物 |
| C、原子半径的大小顺序:r(X)>r(Y)>r(W)>r(Q) |
| D、元素X、Y的最高价氧化物对应的水化物之间能发生反应 |